
1.范围
1.1本文介绍滴眼剂和口服溶液的抑菌剂用量研究及抑菌效力研究。
1.2抑菌剂一般应用到多剂量制剂中。尤其是那些含水的制剂,如口服溶液、混悬液和乳剂,外用溶液,重复使用的膏剂和无菌制剂,最容易受到污染。鉴于我国注射剂一般不采用多剂量,因此不做注射剂的抑菌剂研究。
2.内容
2.1依据
欧洲药品管理局(EMA)在《药品注册上市许可申请材料中对辅料的要求》(Guideline on Excipients in the dossier for application for marketing authorisation of a medicinal product)中,抑菌剂是单独列出,严格要求的。抑菌剂的作用是防止药物在使用条件下产生的微生物增殖。它这种特性归因于某些化学基团,这些化学基团通常对活细胞有害,在临床使用时可能会带来一定的风险。因此,除非十分必要,否则应尽量避免使用抑菌剂。特别是对于儿科用药,更应把抑菌剂的用量控制在可接受的最低水平。
《溶液型滴眼剂仿制药药学研究技术指导原则(征求意见稿)》中指出,多剂量滴眼剂一般应加适当抑菌剂,抑菌剂的用量应按照《中国药典》四部通则 1121 抑菌效力检查法进行筛选确定。处方的抑菌效力应符合中国药典抑菌效力检查法的规定,并确保其可保障产品整个生命周期(包括使用期)的质量要求。
《儿童用药(化学药品)药学开发指导原则(试行)》中指出:当制剂中必须添加抑菌剂时,应对抑菌剂的选择充分论证,抑菌剂的浓度应该保持在满足抑菌功能的最低水平。这对新生儿或需长期用药的人群尤为重要。
2.2要求
欧洲药品管理局(EMA)在《药品注册上市许可申请材料中对辅料的要求》对于每一种抑菌剂而言,研究内容中都应该包括:
(1)使用的理由和用量的合理性
(2)安全性和有效性的证明
(3)药品生产过程中的控制方法
(4)在打开和未打开容器中的存贮水平
(5)在药品标签上注明详细信息
2.3滴眼剂中抑菌剂的研究
2.3.1滴眼剂的抑菌效力标准
滴眼剂属于无菌制剂,按照中国药典2020版四部通则1121抑菌效力检查法的相关要求,其标准如下:
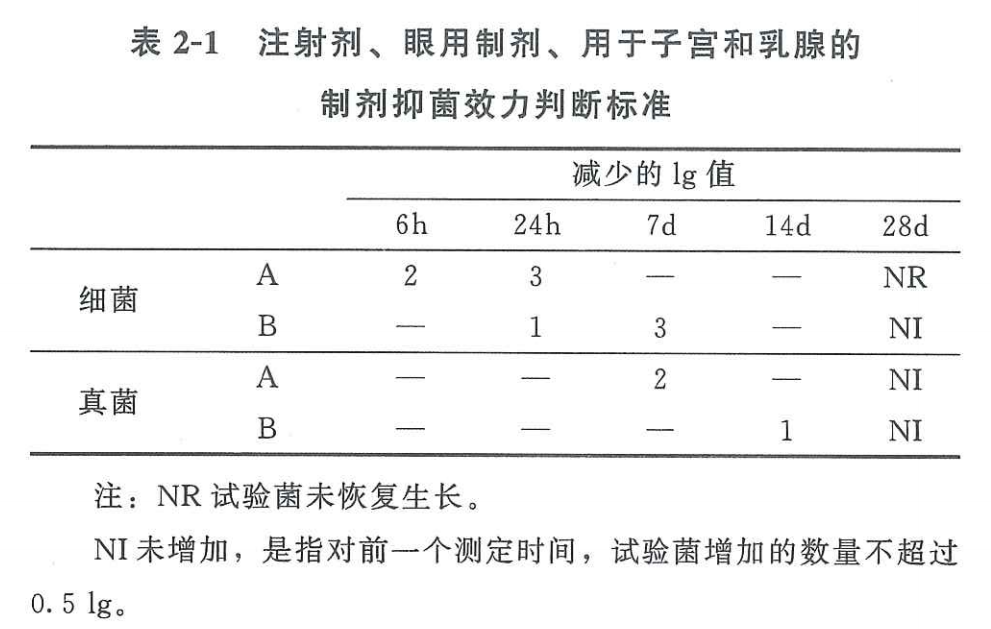
检测结果符合标准A或标准B均视为通过。
2.3.2滴眼剂的常见抑菌剂
最常见的是苯扎氯铵,其次苯扎溴铵、三氯叔丁醇等。硼酸及多元醇等辅料在起到其他理化作用的同时也有一定的抑菌效力。
2.3.3研究方式
抑菌效力研究应在处方开发阶段进行。以参比制剂抑菌剂(一般为苯扎氯铵)的用量为基准,分别加入0%、25%、50%、75%、100%的用量,按照开发好的方法进行抑菌效力考察。一般而言,不加抑菌剂的处方抑菌效力不能符合标准;而即使加入的抑菌剂用量较低(25%或50%),也能顺利达到标准。这样的结果,一方面可以确认抑菌剂用量的合理性;另一方面也为抑菌剂含量的质量标准(如苯扎氯铵含量为标示量的80~120%)制定提供了依据。
2.3.4参比制剂抑菌效力不符合中国药典的情形
在2010年之前,我国是没有抑菌效力标准的。后来主要是参照了欧盟的标准,在药典中规定了抑菌效力测试。但要特别说明的是,各国的抑菌效力测试的标准是不一致的:
从标准来看,中国药典和欧洲药典相同,最为严格,美国药典其次,日本药典最为宽松。在已公布的参比制剂目录中,有相当数量的滴眼剂参比制剂来源于日本。由于国内的抑菌效力试验标准严于日本,这就意味着在日本上市的滴眼剂,甚至于早年日本进口国内的滴眼剂不一定能达到国内的抑菌效力标准。
如果在研究以日本上市滴眼剂为参比制剂的项目时,要同时调研原研在欧美上市的处方。如两者处方不同(一般是欧美上市处方加入了抑菌剂或抑菌剂用量较大),要及早进行抑菌效力试验,以确认抑菌剂等处方成分是不是需要变更。
2.3.5生产放大时苯扎氯铵含量研究
苯扎氯铵在水中极易溶解,在水中溶解搅拌后很快形成均相溶液,理论上其含量是稳定的。但其水溶液的特点是振摇时产生多量泡沫。形成泡沫的苯扎氯铵溶液不再是均相的溶液,其上层的泡沫含有的苯扎氯铵含量较高,而下层清液的含量较低。基于这个特点,滴眼剂产品在放大生产会由于搅拌、自循环、均质、过滤等原因造成苯扎氯铵含量不均一的现象。具体研究方式见《生产放大时苯扎氯铵含量研究》
2.4口服溶液中抑菌剂的研究
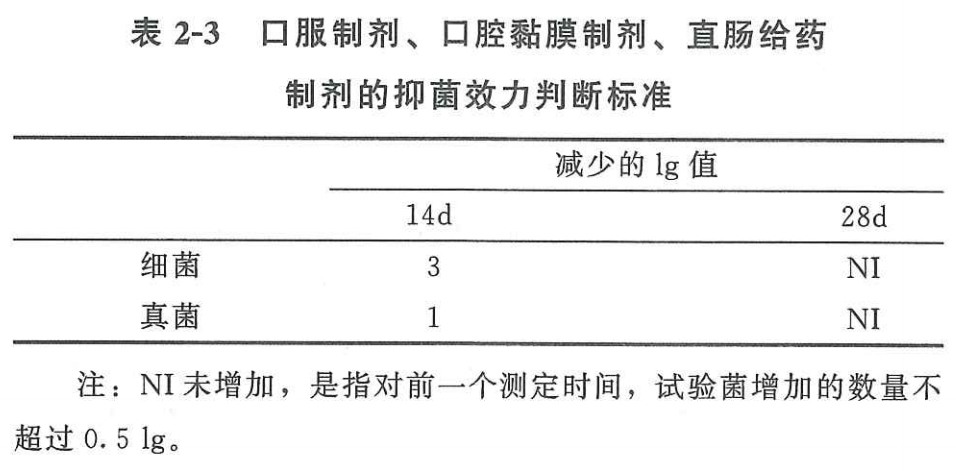
2.4.1口服溶液的抑菌效力标准
口服溶液属于口服制剂,按照中国药典2020版四部通则1121抑菌效力检查法的相关要求,其标准如下:

2.4.2口服溶液的常见抑菌剂
常见有苯甲酸钠、山梨醇、羟苯甲酯、羟苯丙酯等。
2.4.3研究方式
口服溶液与滴眼剂一致,抑菌效力研究应在处方开发阶段进行。以参比制剂抑菌剂的用量为基准,分别加入0%、25%、50%、75%、100%的用量,按照开发好的方法进行抑菌效力考察。
与滴眼剂不同的是,口服溶液还应进行不同pH值条件下的抑菌效力研究,以作为pH值范围的确定依据。欧洲药品管理局(EMA)在《药品注册上市许可申请材料中对辅料的要求》中提到,抑菌效果会因为抑菌剂化学结构、浓度,制剂的化学和物理特性(尤其是pH值)和初始的微生物污染水平不同而不同。这几个因素中,抑菌剂化学结构、浓度都是固定值,微生物污染水平也可以经过原辅料的质量控制和工艺中的减菌步骤得到有效的控制,最大的变量(也是影响最大的)即是药液的pH值。滴眼液品种由于其剂型特点,pH值一般严格控制在6.0-8.0这一较小的中性范围内,而且由于大部分滴眼剂产品都加入了缓冲剂,其pH值往往局限在一个更小的固定范围内。而口服溶液的pH值相对更加宽泛,因此pH值对抑菌效力的影响应纳入研究内容。在研究时要包含拟定pH值的上限及下限,确保在整个pH值范围内药液的抑菌效力都能达到中国药典的要求。
参考资料:
--中国药典/USP/JP/EP等
--Guideline on Excipients in the dossier for application for marketing authorisation of a medicinal product
--《儿童用药(化学药品)药学开发指导原则(试行)》
--等等
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论