
2022年1-10月,我国仿制药企业在美国市场获FDA批准的ANDA批文已有63个(不包括暂时性批准,下同),已经超过了2021年的51个,将进入二次高位。
我国仿制药企业获FDA批准的ANDA批文的数量变化(含收购)
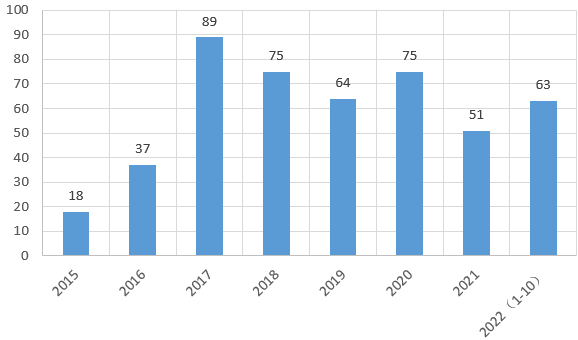
2017年是我国仿制药企业申报ANDA最为活跃的一年,获FDA批准的ANDA批文一共有89个,但那个时候很多企业申报ANDA更多只是为了找FDA考个“证”,真实的目的是想利用FDA的“证”等同通过一致性评价,而且也希望在招标的过程中享到更高质量层级的价格。然而在2018年之后,我国开始实施集采,而且CDE的审批速度也大幅提高,这种“操作”的意义比较有限,愿意去花这个“冤枉钱”的企业数量大幅减少,所以ANDA批文数量开始逐渐下滑。然而随着集采的不断深入,国内仿制药市场利润大盘急剧收缩,有远见的企业开始意识到这一点,2020年之后,申报又再次活跃企业,2022年的ANDA批文数有望超过70个。
除了批文数量的增多,还有一个关键的趋势就是批文质量的升高。从国内企业申报的ANDA批文而言,其目的不再是去“考证”,而是真想发展海外市场了。首先,高壁垒制剂明显增加,如美托洛尔缓释片、罗匹尼罗缓释片、富马酸二甲酯肠溶胶囊、单硝酸异山梨酯缓释片、奥司他韦混悬剂、注射用万古霉素、注射用达托霉素等;其次是注射剂显著增加,美国仿制药市场中,口服制剂竞争更为激烈,而注射剂药价相对较高,说明这些企业的产品布局是经过仔细研究美国市场的;三,出现了一些特色产品,如钆喷酸葡胺造影剂、碘克沙醇注射液、注射用米卡芬净、瑞加德松注射液等,这些产品都是美国市场供给不足的产品,含钆造影剂当年还被FDA鼓励仿制;四,名单中的新企业越来越多,如上药集团、山东新时代、浙江九州等;五,我国企业首次在美国挑战专利上市,东阳光开启了国内仿制药企业到美国挑战专利的先河(《由东阳光药业芬戈莫德胶囊成功挑战专利首仿上市引发的思考》)。
虽然美国的仿制药竞争已经白热化,是一片红海的市场,但在宏观的红海市场中,仍有局部的蓝海区域,一是高门槛的品种,二是具有特色的小众品种,三是首仿药。另外,获得美国的“认证”,仿制药可以畅通无阻地销往广大非法规市场,是仿制药迅速国际化的有效途径。随着我国仿制药市场总利润盘的逐渐萎缩,仿制药企业想要做大规模,国际化是必然的路径,而居住着40亿人口的非法规市场和非规范性市场是仿制药市场的远景所在。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论