

入行系列已经更新到第四篇,也大致介绍了药学研究的内容。
相关阅读:
前两天有朋友问我有关参比品的问题,为何叫参比品,出处是哪里。想起当年对标准品、对照品傻傻分不清,直到后来需要起草相应文件时,才较为系统的学习了这些术语。
有时跟同行交流或者在写文字,尤其是在写官方的申报资料时,一些专有名词尤其需要注意。决定开了一个系列——提高专业度之专有名词概述。
有同行会觉得纠结这些词是在咬文爵字, 只要大家能理解即可。 但在我看来,学习专业术语是提高个人知识内涵的一个基础要素,另外正确使用术语是协调各方的理解一致,同时可以减少使用误区。 就比如在中国药典中,同一个物质,不同批次经验证用于不同实验目时,会赋予不同的名词,这样看到名称即可知道用在何种实验中,详见P7例子。
今天主要来解决 标准品、对照品、参比品 傻傻分不清。


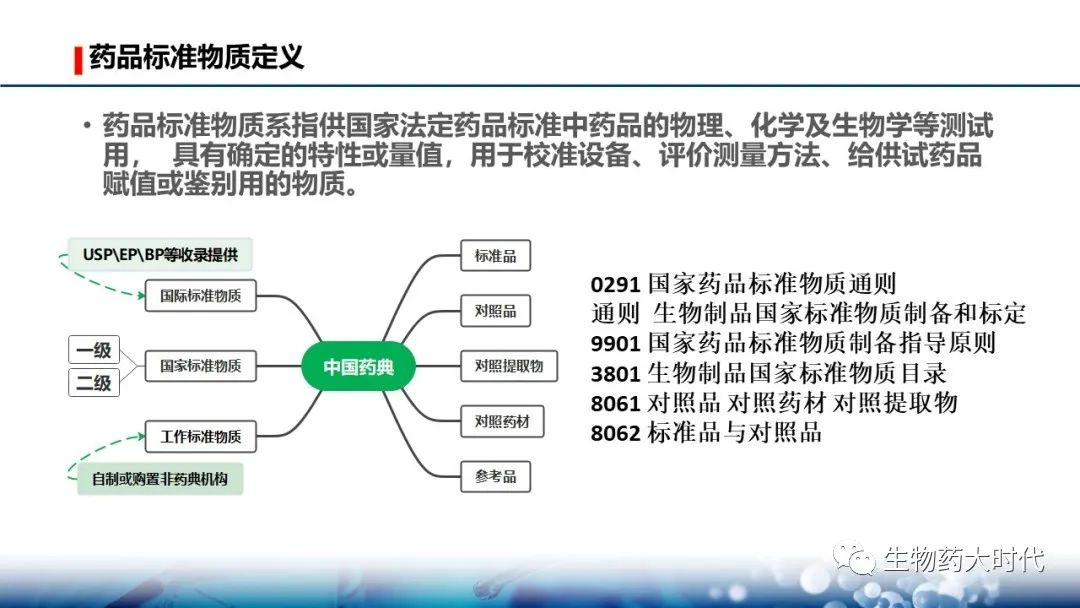
首先,按照《中国药典》这些用于测定时具有确定特性或量值得都称为标准物质。
左边的是分级,可分为国际、国家、工作三级。 国家又可继续分为2级,这与国外的法规基本对应,右侧为不同标准物质的分类。

WHO网站上出售的标准物质主要来自于NIBSC。

按照《0291 国家药品标准物质通则》标准物质分五类,有定义可知道,针对生物制品可能会用到的就三个:
- 标准品——用于生物检定。个人觉得,这个概念很宽泛也很不明确,导致标准品这个词被滥用,很多人误会把标准品等同于标准物质。
- 对照品——生物制品理化测定部分的检测及仪器校准用,就也就是色谱、电泳等用到的系统适用性对照品。
- 参考品——用于生物效价和生物活性试验中的标准物质。

上图做了一个案例展示。但在实际工作和分类中,对照品和标准品在企业包括在国家单位,区分并不明确。因而,在某些表述时会用标准品(对照品)这种并列关系来用。


个人见解,该名词来源《人用重组DNA蛋白制品总论》。

由此可知,参比X 是除那五大标准物质以外的另一个专有名词,对应英文中的reference, 其中小分子药物领域也是大家最为熟知的为参比制剂。
而在生物制品中,更准确的表述为参比品。

如上更新对比了2015年和2020年药典《人用重组DNA蛋白制品总论》,2015年是以参比品作为此为重组DNA蛋白制品的标准物质专有名词,2020年版 3.1.6 统一成了标准物质,但在正文中还是出现了多次参比品。

同理,人用重组单克隆抗体制品总论,2015年是以参比品作为单抗制品的标准物质专有名词,2020年版 3.1.6 统一成了标准物质,但在正文中仍出现了多次参比品。
但是在2020年版中国药典中新加入的《人用聚乙二醇化重组蛋白及多肤制品总论》,依然沿用参比品,个人猜测估计是未修正沿用了2015年《人用重组DNA蛋白制品总论》。
从这些指导原则细微修改里也可看到,国内文件正在逐步统一表述。
另外个人也联想到 ICH的一些中文翻译稿,也是表述较乱,包括 M4 3.2.S.5 或3.2.P.6 写的是“对照品” 这个表述也是有问题的,对照品主要适用于化药。 预计后续修订,该处可能会修改为标准物质。 与reference standard 完全对应。
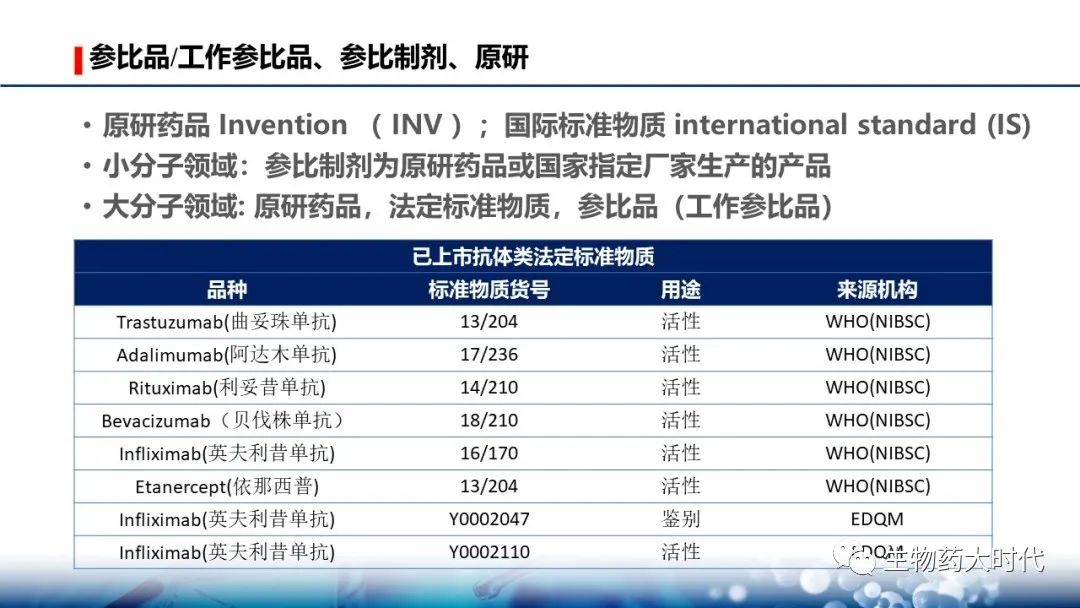
抗体类法定标准物质也同小分子标准物质,因为用途不同,可以进一步被称为对照品或参考品。若共有,则可称为参比品。 有了法定的参比品,那么企业自制的更确切的称呼为工作参比品(In house )。 抗体药主要以新药为主,因而企业自制的工作参比品也常直接简称为参比品。
原研药物有各个批号且有有效期; 法定标准物质当下仅有一个批次,且不设有效期,根据复验结果确定有效期。
对于生物类似药, 即有原研药品和法定标准物质, 我个人理解是原研药品是有批间差异的,需要多批次的数值,法定标准物质更接近于原研厂家用的参比品。
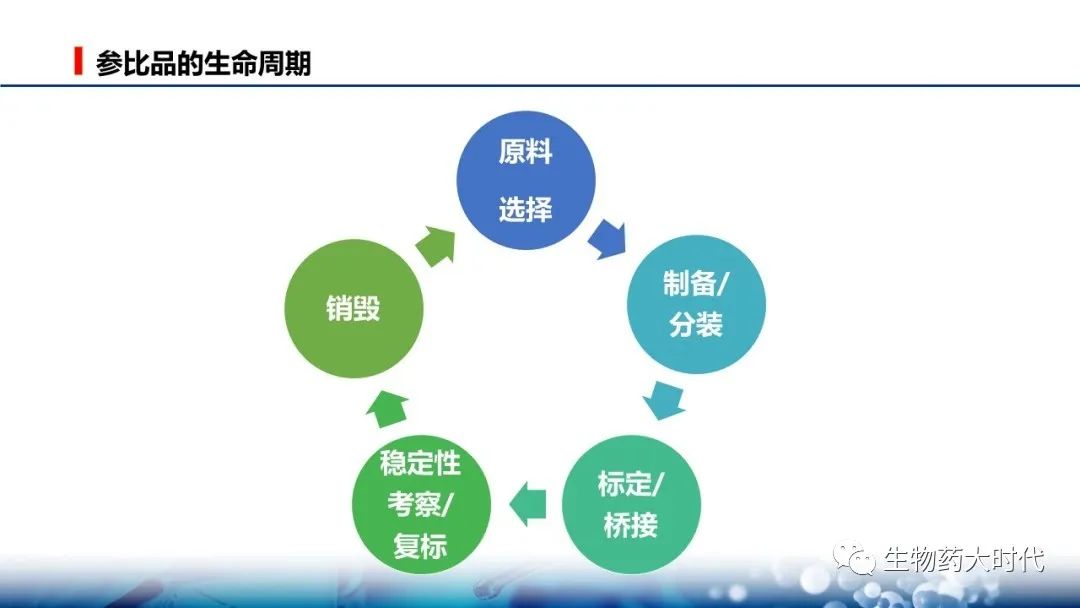

通常,以IND前用于正式GLP毒理研究批次的原液分装到冻存管后作为第一批正式的参比品,英文缩写RS(Reference Standard ),更确切的称呼为工作参比品(in house / Working Reference Standard )。
这批参比品之前的标准物质,根据各公司习惯,可称为过渡、临时参比品等。
在临床试验期间实际情况,再更换批次。

IND阶段也需要展开全面的结构确认和理化特性研究,但较NDA阶段可略删减,如功能实验的ADCC、CDC等部分,若抗体并非通过此作用发挥作用,可用亲和力检测进行代替。检测方法也可选其中完成即可。

参比品的标定、桥接是个复杂的过程,生物制品由于有空间构象问题,同时活性方法的变异相对大,且大多药物又缺少法定的标准物质,会导致活性桥接的复杂。需要更多统计学维度评估。 一说需要20-40个活性数据去评估工作参比品的数值。
若需要进一步探讨参比品相关内容,可再阅读其他文献,如Reference Standards for Therapeutic Proteins。
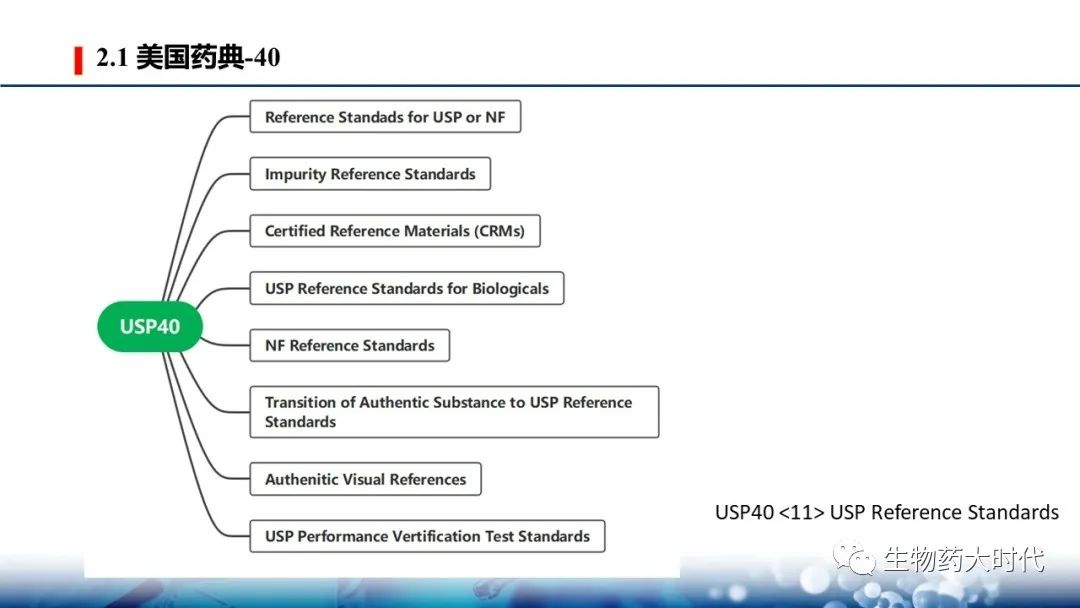
USP40中 通用文件11 USP Reference Standards 有关标准物质的类别共分为8类 :
- USP或NF正文中的标准物质 Reference Standards for USP or NF Articles
- 杂质标准物质 Impurity Reference Standards: 命名规则: “X related compound Y RS” X表示药品名词,Y表示按字母排序的物质。 混合的标准物质 常称为 X System suitability RS
- 有证标准物质Certified reference materials CRMs:根据国际标准化组织(ISO)指南30–35,USP的有证标准物质(CRM)是提供具有相关不确定性和计量可追溯性的认证属性值的标准物质。正确使用这些CRM有助于实现结果对国际单位制的可追溯性和程序的可比性
- 美国药典生物制品参考物质 USP Reference Standards for Biologicals:USP为生物药物和辅助材料提供标准物质。辅助材料如ProtienA
- NF 标准物质,NF Reference Standards:根据1975年1月2日USP和NF在USP中的合并,目前标记为“NF参考标准”的参考标准将被指定为“USP参考标准”
- 可信纯度物质:Transition of Authentic Substances to USP Reference Standards,AS通常是高度特征化的化学品,通过合作测试,主要为分析、临床、制药和研究实验室提供服务。此类材料可用于识别、方法开发、方法性能评估或用户认为合适并经验证的其他应用。USP将不再引入标有“可信纯度物质”的材料
- 真实视觉标准物质. Authentic Visual References:与化学参考材料不同,真实视觉参考(AVR)不用于化学分析。相反,AVR是分析员用来比较某些供试品的视觉图像,以确保它们符合药典要求。AVR通过引用收录到各专著中
- USP性能确认标准物质 USP Performance Verification Test Standards:这些材料是为了进行分析,并在适当的情况下便于调整仪器的操作 确保得到的结果是准确的、精确的,给出可接受的结果
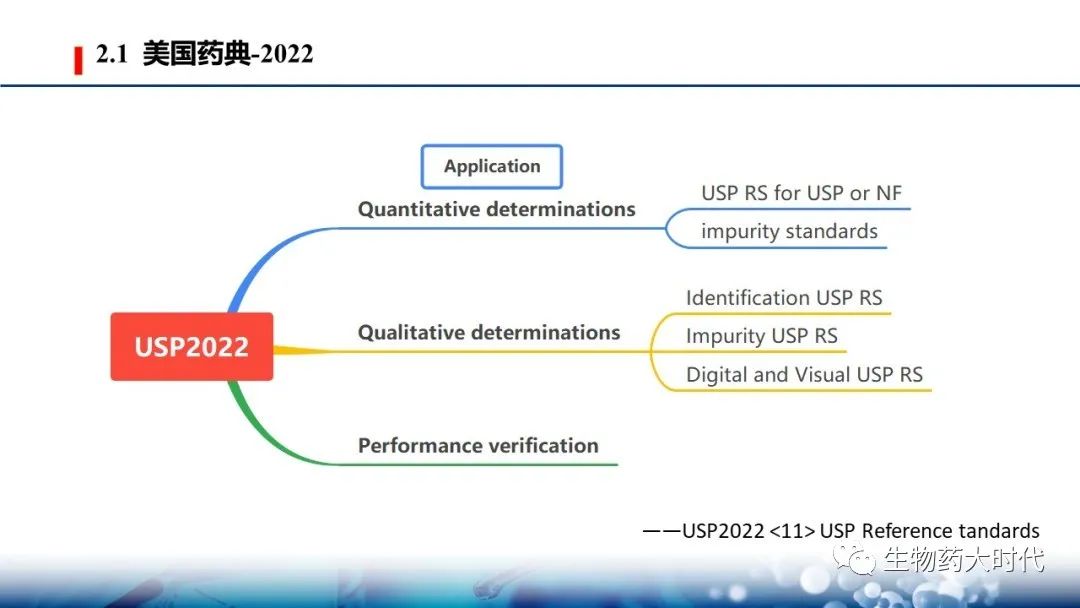
2020年11月开始,USP-NF 的名称将为“USP–NF 2021 “(先前称为USP 44–NF 39) ,该版本未按之前版本分类,而是根据应用场景分成三类
一、定量 Quantitative determinations
A、大多数用于定量测定的USP RS支持以质量为基础的材料总量测量。这一类别包括USP或NF物品的USP RS和标记为定量使用的杂质标准。USP RS的赋值在标签上注明,并应包含在专论和适用一般章节中使用的计算中 。
B、对于复杂材料(如生物制品、抗生素、草药、某些膳食补充剂)的测量,通常需要使用USP RS进行效价或活性的相对测定,定量可以用质量以外的单位或相对效价术语表示。
二、定性Qualitative determinations
1、定性USP RS:鉴别试验的USP RS通常是高化学纯度的单一成分,但也可能是天然、合成或重组来源的复杂材料(例如生物制品、天然产品、植物、复合非生物制品等)。对于复杂材料,识别属性显示在其他材料的矩阵中,需要高度特定的测量系统(例如,天然衍生材料的基于核酸的身份确定)。
2、杂质USP RS:杂质USP RS通常用于系统适用性或作为杂质标记。它们可以表现为单组分材料、含有一种以上杂质的混合物或含有一种或多种杂质的原料药 。
3、数字和可视化USP RS:与化学参考材料不同,这些USP RS不是用于化学分析的物理材料。相反,分析员使用这些视觉图像来比较试验品,以确保它们符合药典要求。
三、性能确认 Performance verification
这些USP RS通常用于一般测试和化验,用于分析,并在适当情况下促进仪器操作的调整,以确保获得的结果准确和/或精确,或以其他方式给出可接受的结果。这些USP RS的使用通常在相关的一般章节和随USP RS提供的支持文档中进行描述。
此外,USP 标准物质目录中,Product type也仅分为了两类,Reference Standard 和 Pharmaceutical Analytical Impurity。

欧洲药典 EP11 5.12中标准物质也分为三级,共6类。
① 一级标准物质:一种被指定或广泛认可的具有最高计量质量的标准,其性能值在特定环境下不参考具有相同性能或数量的其他标准而被接受。该定义不包括国际标准。
② 国际标准物质:为使生物或免疫检测程序的结果能够在全世界以同样的方式表达而提供的主要标准。赋值采用国际单位(IU)或其他合适的单位。世界卫生组织(WHO)通常根据国际实验室间研究以任意方式将该装置指定为第一个国际标准。在适当情况下,通过与以前的标准进行比较,将国际单位中的活动分配给替代国际标准。
③ 二级标准物质:其属性值是通过与具有相同属性或数量的一级标准物质进行比较而指定的。
- 欧洲药典标准物质:欧洲药典委员会制定并采用的参考标准。
- 欧洲药典化学标准物质(CRS):欧洲药典专著或总章中规定的拟使用的物质或物质混合物。CRS是一般的一级标准,但以国际单位校准的标准(尤其是抗生素)除外。后者是可追溯到国际标准的二级标准。
- 欧洲药典草药标准物质(HRS):欧洲药典专著或一般章节中所述的草药制剂(通常为提取物)或拟使用的草药。除非另有规定,否则HRS被指定为其预期用途的一级标准物质。
- 欧洲药典生物标准物质(BRP);欧洲药典专著或总章中规定的拟使用的物质或物质混合物。BRP是以国际单位校准的二级标准或一级标准物质,可用于定义欧洲药典单位(欧洲药典)。也可以使用其他指定内容,例如病毒滴度或细菌数量。
- 标准材料(RM):就一种或多种规定性能而言,具有足够均匀性和稳定性的材料,已确定适合其在测量过程中的预期用途。
- 有证标准物质(CRM):具有一种或多种规定特性的计量有效程序的标准物质,附有说明规定特性值、相关不确定度和计量可追溯性声明的证书。

最后聊聊ICH指导原则, 在ICH Q7和Q6中也有同样阐述,将标准物质分为两级。
但个人以为在中文翻译稿直接将其翻译成标准品是不合适的,此有历史原因,再修订时应该仍是 “标准物质”。

ICH Q6B 质量标准:生物技术产品及生物制品的检测方法和验收标准中也针对生物制品也提到的reference standard。 当然由于历史原因 中文翻译稿的术语也不规范。按目前的叫法应该时标准物质/参比品和标准材料。
其提到未有国家/国际标准物质时,应选择代表生产和临床研究的批次,经质量特性分析后建立一级工作参比品,内部检测参比品应用一级参比品标化。 且生物学和理化检测等检测时也可分别在建立各自标准物质。
之前也有文章提到,由于生物制品的复杂性,在桥接和标化过程,应采用二级流程,如有四个参比品A\B\C\D, 应用一级参比品,分别标化B、C、D,而非A 到B 到C到D。

简要聊了聊标准物质,如有理解不对的请留言或私信。
如有需要本文PPT,可关注“生物药大时代”公众号,编辑发送“参比品”,即可获得,仅供参考。
洪观杰析专栏简介
专栏主理人:程洪杰——CPU随风而逝
中国药科大学本硕连读,在抗体行业拥有十余年经验,在新药发现、成药性分析、蛋白纯化、制剂开发、分析方法开发和质量控制均有丰富经验。参与过Etanercept、infliximab、dulaglutide等多个生物类似药以及多种单抗、双抗、融合蛋白新药的CMC研究,并成功将多个产品推向临床。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论