
对于在研药物而言,临床侧重于研究产品的安全性和有效性,药学侧重与研究产品的稳定性和均一性。说到剂型,固体制剂比较关注原辅料的粉碎和混合,液体制剂则比较关注的是原辅料的分散和溶解。无论是固体的粉碎和混合,还是液体的分散和溶解,直接影响的是产品的稳定和均一,故产品稳定性研究至关重要,是药物制剂研究的一个永恒话题。因此,本文重点对药物稳定性研究进行介绍。
制剂稳定性试验是在温度、湿度、光线、振摇、使用、时间等影响下,产品质量的变化情况,主要包括影响因素稳定性、加速稳定性、长期稳定性、运输稳定性、使用稳定性。产品稳定性的考察结果可为药品的生产、包装、储存、运输、使用提供科学的依据,亦可为后期产品效期的制定提供参考和支持。
1、影响因素
在药物研发阶段,影响因素考察尤为重要。由于影响因素是在较为剧烈的条件下考察,短时间内可区分出不同处方工艺间产品的稳定性差异,从而节约研发时间,提高研发效率。同时可以为长期和加速稳定性的温度、湿度选择提供参考,亦可为后期产品杂质研究和方法分析提供支持。
高温、高湿、光照是影响因素的常用考察项。其中,高温是最常用考察项,根据制剂特性,可选择40℃和60℃。一般情况下,冷藏药物选择40℃;室温贮存药物选择60℃,考察时间一般为5天、10天、30天,亦可根据个人情况使用7天、14天、30天。吸湿粉末或片剂等需考察湿度对产品影响,可选择25℃/RH90%或25℃/RH75%,可两个条件同时考察,一般考察时长为5天和10天。需要注意的是液体制剂因是密封系统,可不考察湿度影响。
无论哪种剂型,光照考察不可避免。光照考察可分为日光灯、强光。日光灯光照强度为200-300lux,该考察项主要为大生产和临床给药光照时长的制定提供依据和支持。强光光照强度为4500±500lux,该条件可为产品光照稳定性和杂质研究提供参考。考察时长可选择5天、10天、30天,亦可根据个人情况使用7天、14天、30天。
低温循环、冻融循环、放置条件、振摇和氧化可根据制剂特性进行选择性考察。考虑到药物使用或贮藏可能会出现超温情况,一般冷藏药物需考察低温和冻融循环。考虑到包材影响,液体或冻干制剂一般需考察放置条件,例如,正置和倒置。考虑到振摇影响,对振摇不稳定的药物需考察振摇稳定性,例如,蛋白药物。影响因素常见考察项见图1。
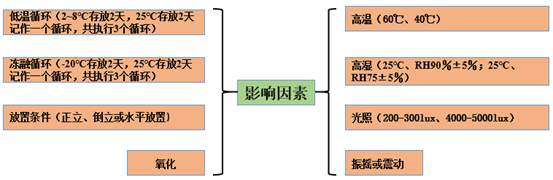
图1 影响因素常见考察条件
2、加速稳定性
加速稳定性主要考察温度和湿度对药物的影响,其条件较影响因素要求低,比正常贮存条件要求高,目的是通过加速药物的化学或理化变化,研究药物制剂的稳定性,以为产品处方设计、工艺改进、质量研究、包装设计、产品运输、储藏提供必要的数据和资料支持。开展加速稳定性研究之前需根据不同制剂的性质和特点进行温度和湿度条件选择,常用制剂加速试验条件见表1。
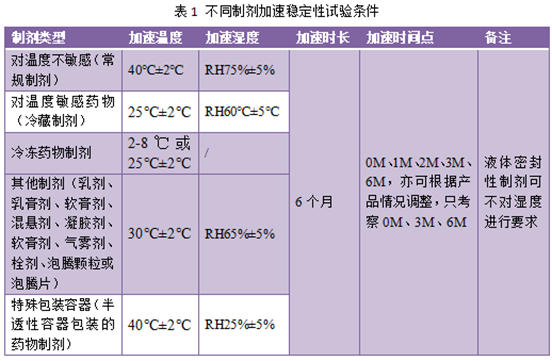
一般对温度不敏感的药物制剂,实验条件:温度40℃±2℃、相对湿度75%±5%的条件考察6个月。检测点可选择0M、1M、2M、3M、6M,亦可根据产品情况调整,只考察0M、3M、6M。
对温度敏感的药物制剂,预计需冷藏(2-8℃)贮存,此类药物的加速试验条件:25℃±2℃,相对湿度60℃±5℃(液体制剂不要求湿度考察),考察时长也为6M,考察时间点与上述相同。
乳剂、乳膏剂、软膏剂、混悬剂、凝胶剂、软膏剂、气雾剂、栓剂、泡腾颗粒或泡腾片,加速条件宜采用温度30℃±2℃、相对湿度65%±5%的试验条件下进行,考察时间及时间点与上述相同。
对于半透性容器包装的药物制剂,例如塑料安瓿瓶、低密度聚乙烯瓶、眼用制剂容器等,加速条件应在温度40℃±2℃、相对湿度25%±5%的条件下进行试验。考察时间及时间点与上述相同。
3、长期稳定性
长期试验是在药品实际贮存条件或接近药品实际贮存条件下开展的,其目的是为制定药品的有效期提供依据。与加速稳定性研究相同,开展长期稳定性研究之前也需根据不同制剂的性质和特点进行温度和湿度条件选择,常用制剂长期试验条件见表2。
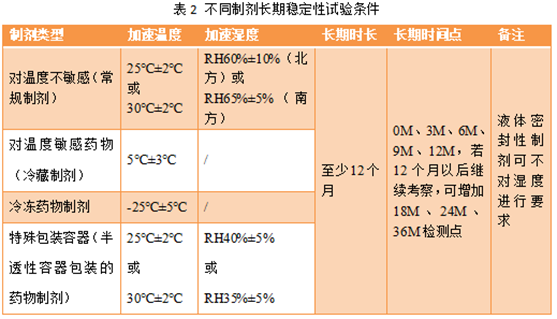
我国地域广阔,南北方温度、湿度存在差异,对温度不敏感药物,其长期试验常用条件:温度25℃±2℃,相对湿度RH60%±10%;若在南方地区也可考虑使用温度30℃±2℃,相对湿度RH65%±5%的条件开展。放置时长应至少12个月,每个3个月取样检测一次,故检测点为0M、3M、6M、9M、12M,若12个月以后继续考察,可增加18M、24M、36M检测点。
对温度敏感的药物,需注意其长期试验条件的选择。拟定冷藏贮存的药物可在温度5℃±3℃条件下考察;拟定冷冻贮藏的药物可在-25℃±5℃条件下考察。
对于半透性容器包装的药物制剂,长期条件应在温度25℃±2℃、相对湿度40%±5%或温度30℃±2℃、相对湿度35%±5%的条件下进行试验。考察时间及时间点与上述相同。
4、运输稳定性
任何药物制剂出厂后都会面临运输的问题,故药物制剂应开展运输稳定性研究。在前期研究中可使用振摇条件模拟运输考察产品稳定性,以提前了解产品在运输过程中搬运、震动、摇晃是否稳定,可为后续产品运输稳定性研究提供参考。随着上市时间的临近,需根据产品市场情况进行运输距离、震动幅度和频率开展真实运输稳定性考察,若是冷藏药品还需考察脱冷链等偏温问题对药物制剂的影响。

5、使用稳定性
影响因素、长期、加速试验考察的均在药物未开封或未使用的状态下进行的研究,无法了解药物使用过程产品稳定性情况,故需开展使用稳定性研究。对于无菌冻干粉末,需考察药物复溶时间、配伍稳定性、使用时长,若给药时间超过4h,还需对产品微生物情况进行评估。对于胰岛素等多剂量产品,需根据临床使用时间和穿刺次数开展使用稳定性研究,需保证使用期间,各项理化、有关物质、微生物等指标均符合要求。

5、总结
稳定性研究贯穿于产品的全生命周期,为药品的研发、生产、包装、贮存、运输、使用和效期的制定提供了有效的数据支持和科学的依据,对药物的安全性和有效性有着至关重要的影响。因此,在开展稳定性研究时,需要对拟定的考察条件进行仔细推敲,保证选用的考察条件具有代表性。只有条件具有代表性,数据才会有代表性,才能够为我们的产品的安全性、有效性、稳定性提供科学的依据。
参考文献:
[1] 化学药物稳定性研究技术指导原则.
[2] 生物制品稳定性研究技术指导原则(试行).
[3] 药剂学人民卫生出版社.
[4] 执业药师考试药学专业知识(一) 中国医药科技出版社
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论