
自身免疫性疾病
自身免疫性疾病是指机体免疫系统对自身成分的免疫耐受被打破,从而异常地攻击自身功能性细胞、组织或器官,这类疾病几乎可以波及身体任何部位,且会反复发作,难以治愈。常见的自身免疫性疾病包括系统性红斑狼疮(SLE)、类风湿性关节炎(RA)、银屑病、炎症性肠病(IBD)等。目前,自免疾病已成为仅次于心血管疾病和肿瘤的第三类主要疾病,根据美国自身免疫相关疾病协会(AARDA)统计,目前已发现100多种自身免疫性疾病,受累人群比例达全球人口总数的7.6%~9.4%。存在大量的临床需求待满足。
药融圈数据(www.pharnexcloud.com)显示,截至2021年底,全球历史上累计销售额TOP10的药物中(除去新冠疫苗),自免药物数量达到了4个,而在TOP5中,自免药物占到了3个,分别是艾伯维的Humira(1978.6亿美元)、辉瑞的Enbrel(1273.9亿美元)、强生的Remicade(1133.7亿美元)。据统计,全球自身免疫性疾病治疗药物市场规模已超过1500亿美元。作为肿瘤和心血管疾病后的世界第三大类疾病,自免疾病难以治愈、多数患者需长期甚至终身用药、严重影响患者生活质量,这些慢病特点将为市场带来持续放量。
全球首款FcRn抑制剂获批治疗全身型重症肌无力
2021年12月17日,美国FDA批准Vyvgart(efgartigimod alfa-fcab)用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)。
全身型重症肌无力(gMG)是一种罕见的慢性自身免疫性神经肌肉疾病,超过85%的肌无力(MG)患者在发病24个月内会进展为全身型重症肌无力(gMG),可能影响全身肌肉,导致极度疲劳和面部表情、言语、吞咽和活动困难。在更危及生命的情况下,可能因为呼吸衰竭、肺部感染等导致死亡。目前,确认携带有乙酰胆碱受体(AChR)抗体的患者约占gMG总人群的85%。
Vyvgart(efgartigimod alfa-fcab)由荷兰生物制药公司argenx开发,是目前首个且唯一一个获批的FcRn抑制剂,也是首个获批的专门针对减少致病性免疫球蛋白(IgG)这一gMG潜在驱动因素的疗法。其本质是一款靶向新生儿Fc受体(FcRn)的人IgG1抗体Fc片段,可防止FcRn将免疫球蛋白G(IgG)循环回血液中,加速IgG的降解,进而降低IgG的总体水平,其中就包括重症肌无力中存在的异常AChR抗体。
下图为Efgartigimod的作用机制:
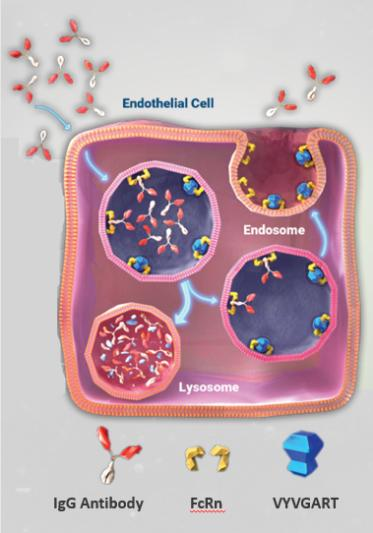
Efgartigimod阻断FcRn-IgG相互结合并将IgG从循环中去除
图源:argenx
多种自身免疫性疾病是由IgG与自身抗原结合引起的,由于FcRn延长了IgG在循环中的半衰期从而加速了自免疾病进程,因此FcRn是治疗这些相关疾病的重要靶点。基于Efgartigimod靶向FcRn以选择性减少IgG的作用机制,其有望治疗IgG介导的多种严重自身免疫性疾病。
除了在美国获批之外,2022年1月20日,日本PMDA批准Vyvgart(efgartigimod alfa-fcab)静脉注射用于治疗对类固醇或非类固醇免疫抑制疗法(ISTs)没有充分应答的全身型重症肌无力(gMG)成人患者。这些监管里程碑促使Vyvgart成为美国和日本第一个也是目前唯一一个获批的新生儿FcRn抑制剂,也意味着Efgartigimod已经成为了多年来重症肌无力创新性药物的新突破,为攻克全身性重症肌无力提供了全新的治疗手段。
- 再鼎医药1.75亿美元引进
在国内,再鼎医药拥有Efgartigimod开发和商业化的独家许可。2021年1月,再鼎医药与argenx达成独家授权合作,再鼎医药将负责推进Efgartigimod在大中华区(包括中国内地、香港、台湾和澳门地区)的开发和商业化工作。根据协议条款,argenx将获得总计1.75亿美元的合作付款,其中包括7500万美元的预付款,以每股132美元的价格发行的568182股再鼎医药增发股票形式支付,7500万美元临床开发成本共担付款,以及Efgartigimod在美国获批后的2500万美元的里程碑付款。argenx同时将按比例获得Efgartigimod在大中华区的年净销售额分成。据披露,再鼎医药预计将在2022年中之前在大中华区提交Efgartigimod的上市申请(NDA/BLA)。
argenx力争成为领先的免疫学公司

argenx(Euronext& NASDAQ:ARGX)成立于2008年,总部位于荷兰,是一家商业化阶段、全球性、完全整合的生物技术公司,致力于开发用于治疗严重自身免疫性疾病的差异化疗法。通过将抗体工程技术套件与研究合作者的疾病生物学专业知识相结合,argenx旨在将免疫学突破转化为基于抗体的新型药物管线。该公司重视团队与合作,argenx这一名字来源于古希腊神话中的“阿耳戈英雄”(Argonauts),阿耳戈英雄们的故事中就描述了数十名英雄通过团队力量完成了看似不可完成的任务。
- 免疫学创新计划(IIP)
免疫学创新计划(IIP)是argenx公司的发现引擎,将公司的外部科学和学术合作者对疾病和生物学机制的深刻理解与公司的抗体工程经验相结合,以建立高度差异化的管线。无论是argenx独有的还是合作开发的候选产品都来自IIP计划。IIP计划也是公司长期战略的一部分,argenx计划每年从中孵化出至少一项新的管线资产。
IIP计划主要合作示例:
● 已获批的Efgartigimod(原研发代号ARGX-113)就源于公司与德克萨斯大学西南医学中心(UTSW)和Sally Ward教授的合作,后来成为了IIP的蓝图之一。Ward教授的研究在2013年确定了FcRn在IgG水平的维持和全身分布方面所起的关键作用。(事实上在1990年至2015年间,Ward教授一直领导研究了FcRn在调节IgG抗体水平和持久性方面的作用。2005年,她的团队描述了一种通过抑制FcRn活性来降低抗体水平的方法,并随后展示了该方法治疗抗体介导的自身免疫性疾病的临床前概念验证。)argenx从UTSW获得了与Efgartigimod相关的独家专利权。
●argenx管线中另一款候选药物ARGX-117是与Broteio Pharma合作构建的。该公司于2017年在乌得勒支大学和Erik Hack教授的支持下创立,旨在开展研究以证明ARGX-117作用机制的临床前概念验证。Hack教授就炎症在疾病中的作用,特别是在补体系统中的作用研究做出了卓越的贡献。
下图为argenx的主要学术合作伙伴:

图源:argenx
- 技术套件
argenx的关键技术概述如下:
SIMPLE Antibody平台:基于强大的美洲驼免疫系统,能够开发利用新型和基于复杂疾病生物学的靶点。该平台从远交系美洲驼的免疫系统中获取抗体V区(可变区)。当美洲驼的免疫系统与人类疾病靶点产生免疫反应时,会生成高度多样化的抗体库,这些抗体的V区具有高度的人类同源性或相似性。借助该平台,argenx能够获取并探索广泛的治疗靶点,与使用传统方法相比,最大限度地减少产生候选抗体的时间。
Fc工程化技术:NHance、ABDEG、POTELLIGENT和DHS突变专注于工程化改造抗体的Fc段,以增强其内在的治疗特性。此外,argenx还获得了日本中外制药株式会社关于SMART-Ig和ACT-Ig技术的非独家研究许可和选择权。这些技术使argenx能够通过潜在地调节候选药物的半衰期、组织渗透、清除率和效力来扩大候选药物的治疗指数。
ENHANZE®SC给药技术:argenx与药物递送技术公司Halozyme Therapeutics在2019年2月宣布达成全球合作和许可协议,并于2020年10月扩大协议,argenx对FcRn和C2靶点以及4个其他靶点拥有ENHANZE®技术的独家使用权。ENHANZE®技术可缩短给药时间,并提供额外的给药灵活性和便捷性以提高患者顺应性。
主要产品管线
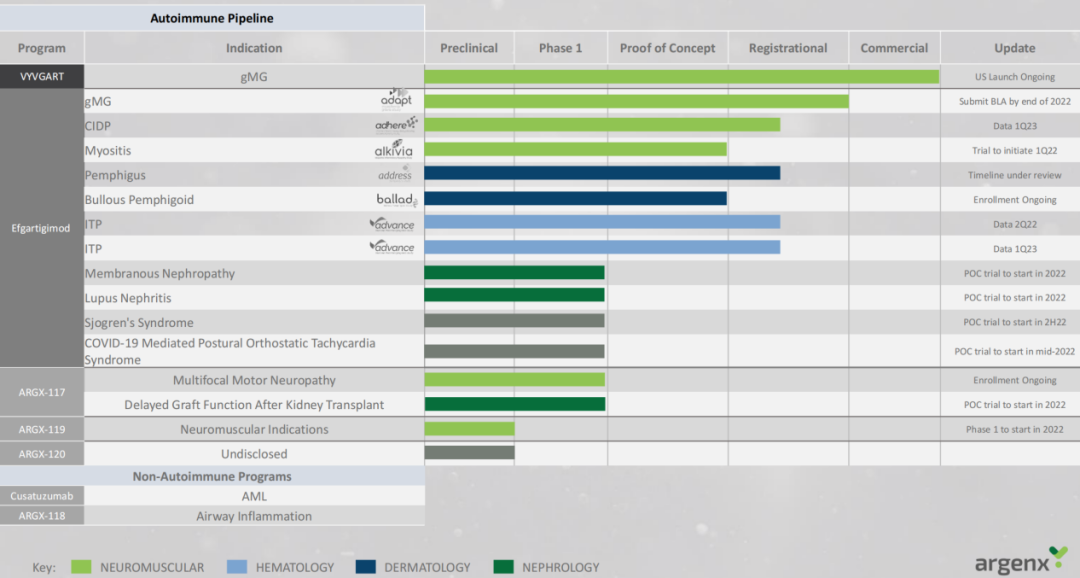
图源:argenx pipeline
在自身免疫性疾病治疗领域中,argenx特别关注神经肌肉、血液学、皮肤病学和肾病学适应症,已开启多项临床试验以支持后续的监管审查。
- Efgartigimod开发&商业化计划
Vyvgart(efgartigimod)获批治疗全身型重症肌无力(gMG)的同时,argenx也在建立全球的开发和商业化足迹。
- 目前已在美国和日本建立了自己的销售队伍;
- 欧盟的审查决定预计将在2022年下半年公布;
- 2022年第一季度argenx在加拿大成立了子公司argenx Canada以支持该产品在加拿大的监管审查和商业化工作;
- argenx与再鼎医药达成大中华地区独家开发和商业化合作协议,预计2022年中之前在大中华区提交Efgartigimod的上市申请;
- argenx在以色列与制药公司Medison达成了独家分销协议,并预计于2022年第二季度在以色列提交上市申请;
- argenx还与GenPharm就Vyvgart在中东的商业化签订商业和分销协议。
除此之外,argenx还计划在其他地区建立分销合作伙伴关系。
对于临床开发,全身型重症肌无力(gMG)适应症对Efgartigimod来说只是一个开始,该药物还在多项自身免疫相关适应症中进行开发,包括原发性免疫性血小板减少症(ITP)、寻常型天疱疮(PV)、慢性炎症性脱髓鞘性多发性神经病(CIDP)、特发性炎症性肌病(Myositis)、大疱性类天疱疮(BP)等。
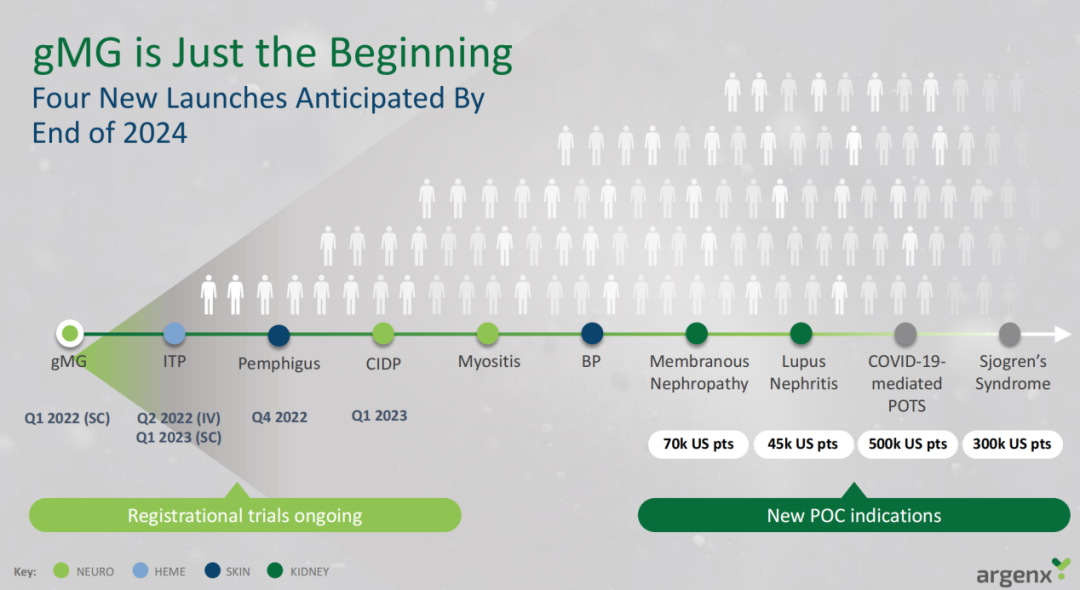
图源:argenx
除了静脉注射制剂,argenx正在开发一种基于重组人透明质酸酶的Efgartigimod皮下注射制剂(SC efgartigimod),该制剂采用ENHANZE®给药技术(从Halozyme Therapeutics公司获得许可)。
2021年1月,argenx开启了3期ADAPT-SC试验,该试验是一项皮下注射SC efgartigimod治疗全身型重症肌无力(gMG)的非劣效性桥接试验,旨在比较皮下注射1000mg SC efgartigimod与静脉注射10mg/kg Efgartigimod的药效作用。2022年3月22日,argenx公布了3期ADAPT-SC试验的积极顶线数据,与基线相比,皮下注射SC efgartigimod在第29天达到了总IgG水平降低的主要终点,证明SC efgartigimod与Vyvgart(efgartigimod alfa-fcab)静脉注射制剂相比具有统计学意义上的非劣效性。基于这些结果,argenx计划在2022年底之前向美国FDA提交一份BLA申请。
另外,argenx还在gMG儿童患者中探索静脉注射Efgartigimod的给药剂量;以及在一项健康志愿者试验中评估同时接受Efgartigimod治疗和23价肺炎球菌多糖疫苗(Pneumovax 23)接种后的免疫反应。
2019年第四季度,argenx开启了一项3期ADVANCE试验,以评估静脉注射10mg/kg Efgartigimod治疗原发性免疫性血小板减少症(ITP)的效果;又在2020年第四季度开启了另一项3期ADVANCE-SC试验,旨在评估皮下注射1000mg SC efgartigimod治疗原发性ITP的效果。这两项试验将分别招募约156名患者,并预计分别在2022年第二季度和2023年第一季度获得顶线数据。
2020年第四季度,argenx开启了一项3期ADDRESS试验,旨在评估皮下注射SC efgartigimod用于治疗约150名新诊断或复发的中度至重度寻常型天疱疮和落叶型天疱疮(PV和PF)患者的疗效、安全性和耐受性。该试验原先预计将于2022年第四季度获得顶线数据,但由于该试验中少数患者在乌克兰或俄罗斯的研究站点,因此目前尚无法评估数据获取的确切时间。
2019年底,argenx启动了一项3期ADHERE试验,评估皮下注射SC efgartigimod用于治疗慢性炎症性脱髓鞘性多发性神经病(CIDP)的疗效,该试验分为一个开放标签的A阶段,以及一个随机、安慰剂对照的B阶段。A阶段后进行的中期分析支持该试验进入B阶段继续招募患者,预计总共招募约130例患者。argenx预计将在2023年第一季度公布ADHERE试验的顶线数据。
2021年下半年,argenx启动了一项2/3期BALLAD试验,以评估皮下注射SC efgartigimod在大疱性类天疱疮(BP)患者中的作用,计划招募160例患者,并计划在前40例患者接受治疗之后进行BALLAD试验的中期分析。
argenx还计划在2022年第二季度启动评估皮下注射SC efgartigimod治疗特发性炎症性肌病(Myositis)的ALKIVIA试验,该试验将在IMNM、ASys和DM三种肌炎亚型队列中招募总共180例患者。公司计划在每种亚型的前30例患者接受治疗之后进行中期分析。
除上述适应症之外,2022年1月,argenx宣布将通过公司与再鼎医药和IQVIA的合作协议,在4种新的自身免疫适应症中启动概念验证试验:膜性肾病(MN)、狼疮性肾炎(LN)、原发性干燥综合征(primary SjS)以及COVID-19介导的体位性心动过速综合征(COVID-19 mediated POTS)。
另据药融云数据(https://www.pharnexcloud.com/?zmt-mhwz)统计,Efgartigimod在国内也开展了多项临床试验:

截图:药融云数据库
2022年4月,argenx在第74届美国神经病学学会(AAN)年会上展示了ADAPT+试验的中期结果。该试验是一项开放标签、为期3年的扩展研究,旨在评估Vyvgart(efgartigimod alfa-fcab)治疗成人全身型重症肌无力(gMG)的长期安全性、耐受性和有效性。中期数据表明,Vyvgart的长期治疗可改善gMG的疾病评分,并在多个治疗周期内保持一致。在5个治疗周期内,患者重症肌无力日常生活(MG-ADL)量表和重症肌无力定量评分(QMG)分别平均改善了5.1和4.7,并在治疗周期之间保持一致。长期治疗显示出持续良好的安全性并与3期ADAPT试验的结果一致。
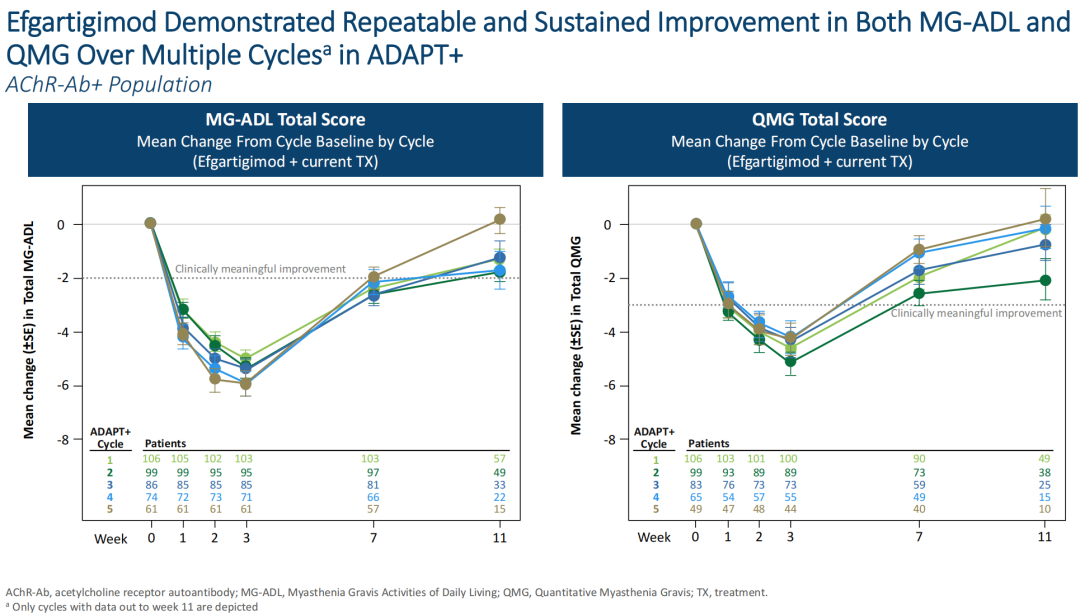
图源:argenx
- ARGX-117
ARGX-117是一种高度差异化的治疗性单克隆抗体,携带argenx专有的NHANCE突变,靶向补体成分C2。C2是补体级联反应中理想的干预靶点。ARGX-117表现出pH和钙离子依赖性结合的独特性质,这使ARGX-117能够捕获循环中的游离C2,并将其释放到内体中,以便在溶酶体中进行分类降解。同时,专有的NHANCE突变增加了ARGX-117对FcRn的亲和力,并使其能够回收利用以捕获更多的游离C2。
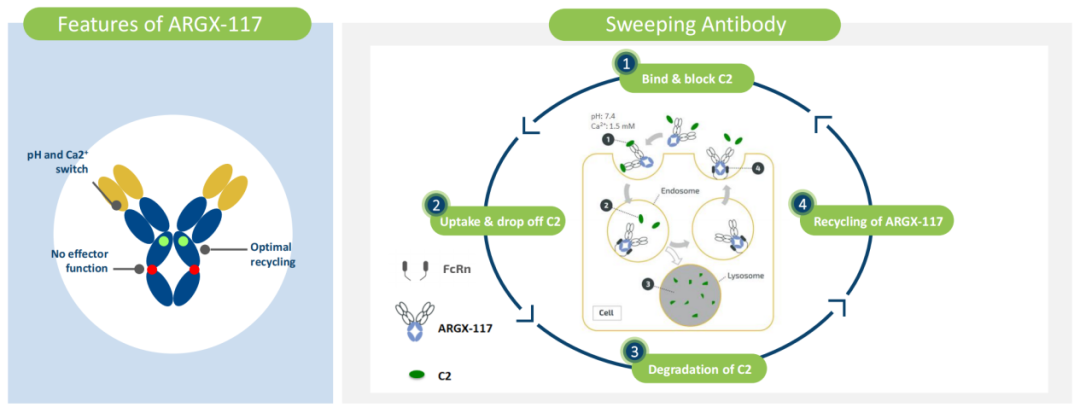
ARGX-117的特性和作用机制 图源:argenx
ARGX-117用于治疗多灶性运动神经病(MMN)的2期临床试验正在启动中,大约招募45例MMN患者;该候选药物用于肾移植后移植物功能延迟恢复(DGF)和/或同种异体移植失败的概念验证试验预计将于2022年下半年启动。
- 外部合作管线
该公司还将免疫学创新计划(IIP)中孵化的多项早期管线资产授权给外部合作伙伴以进行进一步开发,argenx有权获得里程碑付款、特许权使用费或利润分成。主要外部合作管线,靶点等信息如下:

药融圈团队,整理自argenx官方信息
argenx未来战略
- 执行全球商业化发布计划:在全球范围内推出Vyvgart(efgartigimod)用于治疗gMG,并建立基础设施以支持针对其他适应症的商业化活动。
- 扩大主导产品Efgartigimod的应用范围:探索其他适应症,以及在现有适应症范围内扩大目标患者群体,最大限度发挥产品商业潜力。到2024年底,实现另外4次商业发布(针对gMG的皮下注射制剂SC efgartigimod,以及另三种适应症ITP、PV和CIDP)。
- 推进管线资产:推进ARGX-117、ARGX-119以及早期候选产品的临床开发,并通过免疫学创新计划(IIP)扩大候选产品管线。
- 利用专有的技术套件寻求战略合作,并将管线的价值最大化。
- 实现“argenx2025”愿景:在全球范围内为患者提供Efgartigimod产品,并希望将Efgartigimod的商业化或临床开发工作拓展到15项适应症;在ARGX-117的后期临床开发和ARGX-119的概念验证中取得进展;通过继续对IIP计划进行投入以持续扩大差异化的管线,计划每年从中孵化出一项新的管线资产。
- 继续将创新融入argenx发展的每一步,通过IIP计划建立专业和深度合作,将免疫学突破转化为药物。
财务业绩
2022年3月3日,argenx发布2021年全年财务业绩报告。截至2021年12月31日,公司现金、现金等价物和流动金融资产总额为23.367亿美元。全年收入增加4.56亿美元至4.973亿美元,主要是因为与杨森的合作协议终止,获得一次性收入3.151亿美元,并从与再鼎医药的战略合作中获得1.775亿美元的收入(首付款+研发费用分摊+产品获批触发的里程碑付款)。
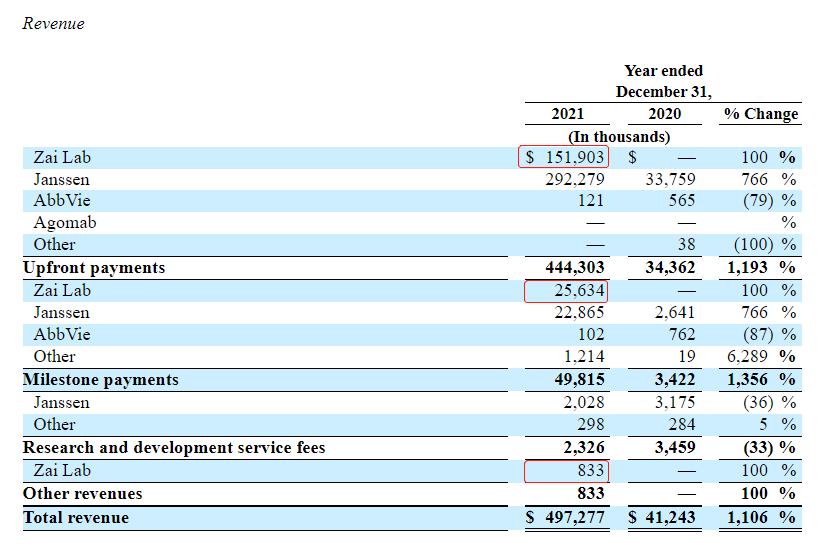
图源:argenx(红框处为再鼎医药合作收入明细)
全年研发费用增加2.096亿美元至5.805亿美元,主要原因是外部研发费用增加,以及efgartigimod的各种适应症和其他临床/临床前开发计划的支出。根据当前计划,argenx预计在2022年将花费其持有的现金、现金等价物和流动金融资产的一半。这些支出将支持Vyvgart(efgartigimod)在全球范围的商业发布,以及Efgartigimod针对10项适应症、ARGX-117针对2项适应症的临床开发活动,投资全球供应链,并通过免疫学创新计划(IIP)继续扩大产品管线。
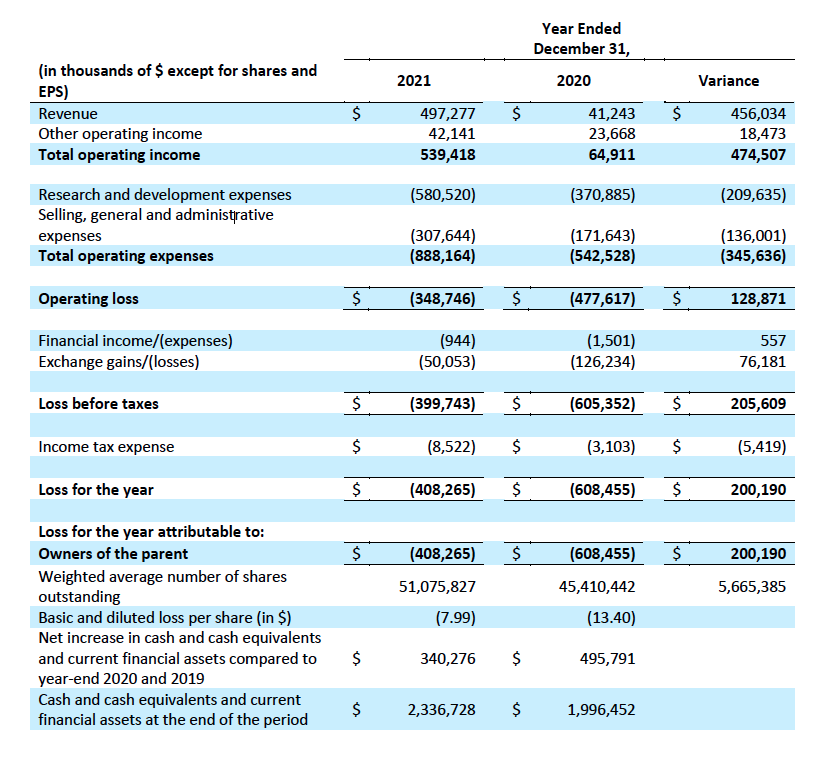
图源:argenx
参考:
NMPA/CDE;
药融云数据,https://www.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
BehinA, Le Panse R. New Pathways and Therapeutic Targets in AutoimmuneMyasthenia Gravis. J Neuromuscul Dis. 2018;5(3):265-277. doi:10.3233/JND-170294. PMID: 30010142; PMCID: PMC6087460.;
Heo,Young-A. “Efgartigimod: First Approval.” Drugs vol. 82,3 (2022):341-348. doi:10.1007/s40265-022-01678-3.;
https://www.argenx.com/;
https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-myasthenia-gravis;
https://www.utsouthwestern.edu/newsroom/articles/year-2022/first-in-kind-drug.html;等等。
想要解锁药企更多信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、临床研发阶段、市场规模与前景;仿制药申报情况、市场竞争格局、销售情况;公司投融资情况、年报与前景,可否投入!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论