
摘要 本文以杂质的定量检查为例介绍如何进行有关物质分析方法的验证,具体包括验证指标和各指标的可接受标准,确定该方法是否适用于本品有关物质的检测。
药品质量标准分析方法验证的目的是证明采用的方法适合于相应检测要求。由于分析方法具有各自的特点,并随分析对象而变化,因此需要视具体方法拟订验证的指标。
一般情况下,验证指标有:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限 、定量限 、线性与范围和耐用性。在分析方法验证中,须采用标准物质进行试验。
1、专属性
空白溶剂/辅料对样品检测无干扰;
各组分之间无干扰;
杂质与杂质之间,杂质与主成分之间应完全分离,分离度一般要求大于1.5以上;
降解试验:一般破坏条件包括酸、碱、氧化、光照、高温、高湿;降解杂质应不干扰主峰,主峰纯度应符合规定,质量守恒(降解量一般在5%~10%)

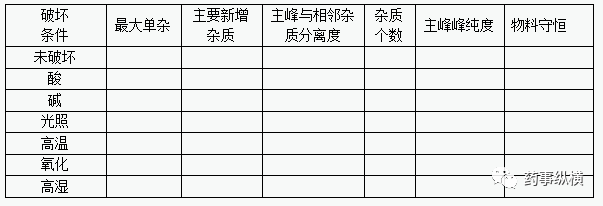
2、系统适用性
配制6份限度浓度的系统适用性溶液进行分析(个人认为可以一份系统适用性溶液连续进样6针,即系统适用性和进样精密度一起考察),杂质峰峰面积的相对标准差应不大于2.0%,保留时间的相对标准差应不大于1.0%。另外,杂质峰的拖尾因子不得大于2.0,理论塔板数应符合质量标准的规定。
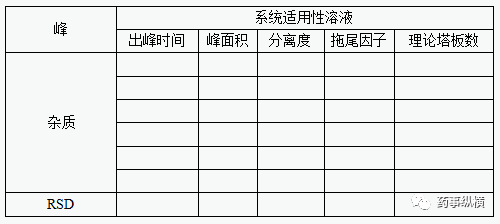
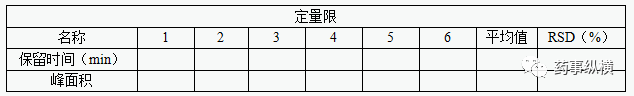
3、检测限、定量限
定量限:对照品溶液稀释至 S/N应约为10,确定定量限;配制6份定量限浓度的溶液,所测6份溶液杂质峰保留时间的相对标准差应不大于2.0%,峰面积的相对标准差应不大于5.0%。
.检测限:将定量限溶液稀释至S/N应约为3,确定检测限。

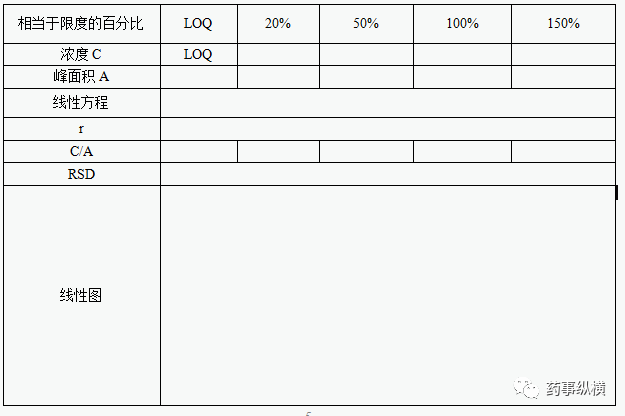
4、线性与范围
在定量限至限度浓度的150%范围内配制至少5份浓度不同的供试液,分别测定杂质峰的面积,计算相应的含量。以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。校正因子为主成分线性斜率除以杂质线性斜率。
回归线的相关系数(r)不得小于0.990,Y轴截距应在100%响应值的25%以内,响应因子的相对标准差应不大于10%。
5、精密度
重复性:在短期时间间隔内,同样操作条件下的精密度,6份供试品单杂含量极差≦限度的20%;杂质峰个数一致;
中间精密度:中间精密度表示在同一试验室下的变异:不同天,不同试验者,不同仪器等;6份供试品同重复性;与重复性项下数据汇总,12个数据单杂含量极差≦限度的20%;杂质峰个数一致;

6、溶液稳定性
一般进对照液和样品溶液,考察时间内各杂质峰面积变化不得过2.0%或者各杂质含量的极差应不大于限度20%,对照液峰面积变化不得过2.0%,并不得出现新的大于报告限度的杂质。考察时间一般为0、2、4、6、8、12、24小时及以上的时间。
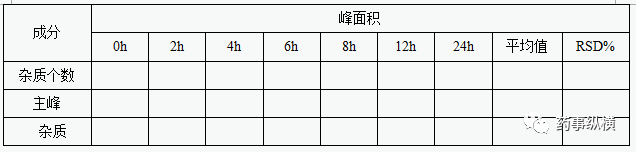
7、回收率
该指标主要是通过回收率来反映。验证时一般要求根据有关物质的定量限与质量标准中该杂质的限度分别配制四个浓度的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率,并计算12个回收率数据的相对标准差(RSD)。
该项目的可接受的标准为:各浓度下的平均回收率均应在80%-120%之间,如杂质的浓度为定量限,则该浓度下的平均回收率可放宽至70%-130%,相对标准差应不大于10%。

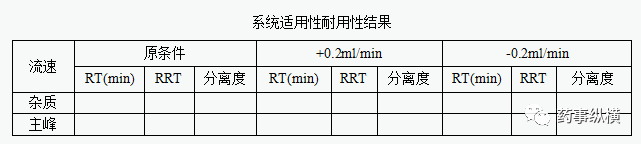
8、耐用性
分别考察流动相比例变化、流动相pH值变化、柱温变化、检测波长变化、流速变化、不同色谱柱以及不同仪器进行测定时,每个条件下各测试两次。可接受的标准为:各杂质峰的拖尾因子不得大于2.0,杂质峰与其他成分峰必须达到基线分离;各条件下的杂质含量数据(n=6)的相对标准差应不大于2.0%,杂质含量的极差应不大于限度20%。
一般波动范围如下:


图片以上内容仅根据个人经验总结,如有不同意见,欢迎交流。
参考文献:
1.中国药典2015版四部通则
2.有关物质分析方法验证的可接受标准简介
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论