2015年8月,《国务院关于改革药品医疗器械审评审批制度的意见》发布,拉开我国药品审评审批改革的序幕,加快了新药研发速度。2016-2021年,短短6年,我国便已有66款国产1类新药上市。从跟跑到努力并行,中国创新药事业一路高歌猛进,破茧成蝶,不断突破国产药自主创新能力弱的瓶颈,中国正从医药制造大国迈向医药创新强国。
不过,国内目前的新药研发与全球领先水平仍然存在差距,尚需努力。国内药企主要面临着以下几个挑战:
6%靶点囊括超4成新药:同质化严重
2016-2021年,我国 I 类新药申请受理数量逐年提高,年复合增长率(CAGR)高达40%。然而,前 6% 的靶点便已囊括了超40%的新药,其中国内仅申报并获CDE受理的PD-L1新药就近60款……在研新药集中度高已是业内不争的共识。
2016-2021新药涉及靶点TOP30
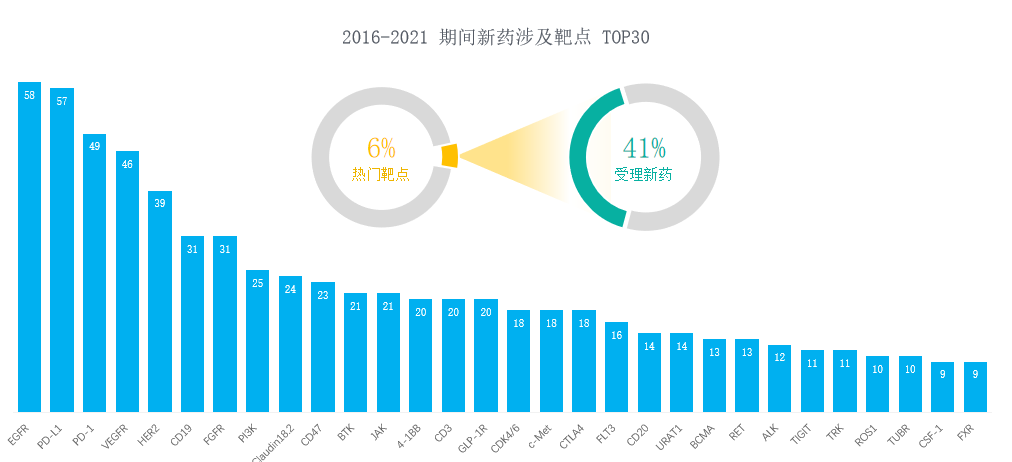
图片来源:中国 I 类新药靶点白皮书
对于药企而言,是选择积极投身热门赛道、还是转身另辟蹊径?不同选择、策略不同,这其中的抉择不亚于天人交战。
热门靶点变迁,研发跟风≠市场保障
铁打的创新药增长,流水的靶点「顶流」。2016-2021年间,申报的新药数量始终增长,热门靶点却是年年不同。2016年,EGFR稳坐热门靶点榜首,2年后却险些跌出前5;Claudin 18.2于2019年前还“查无此人”,2021年就已荣升至TOP2……
2016-2021年热门靶点变迁
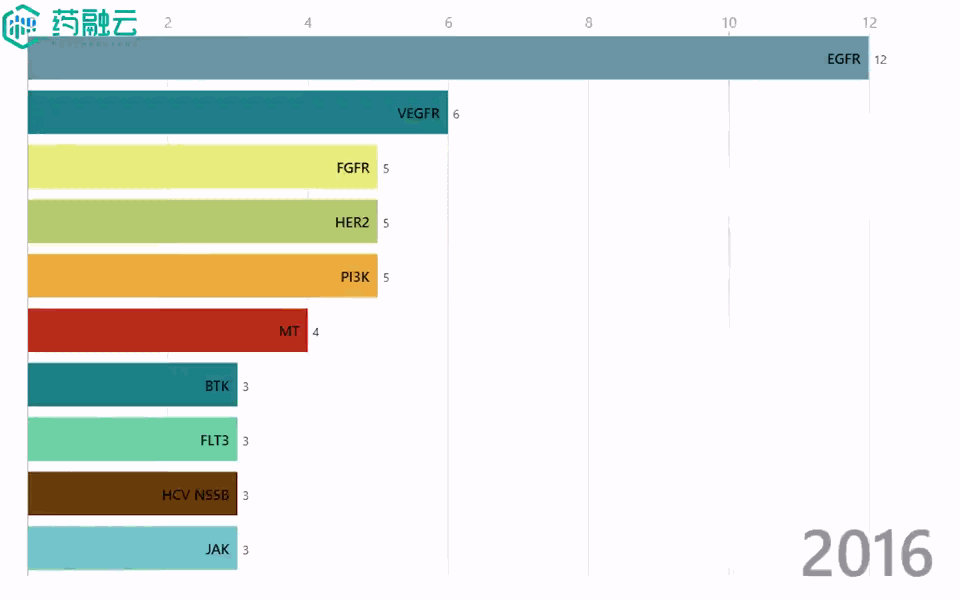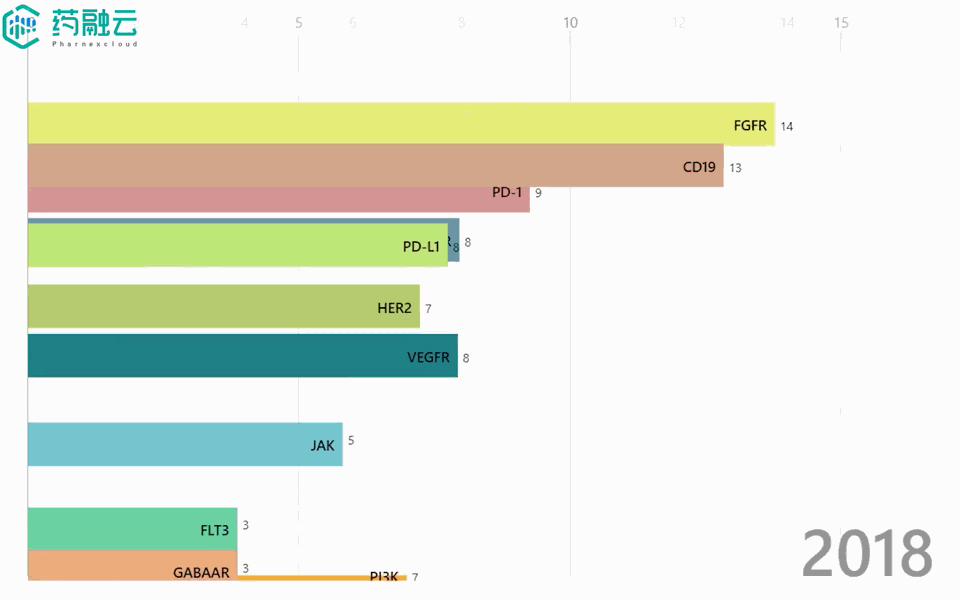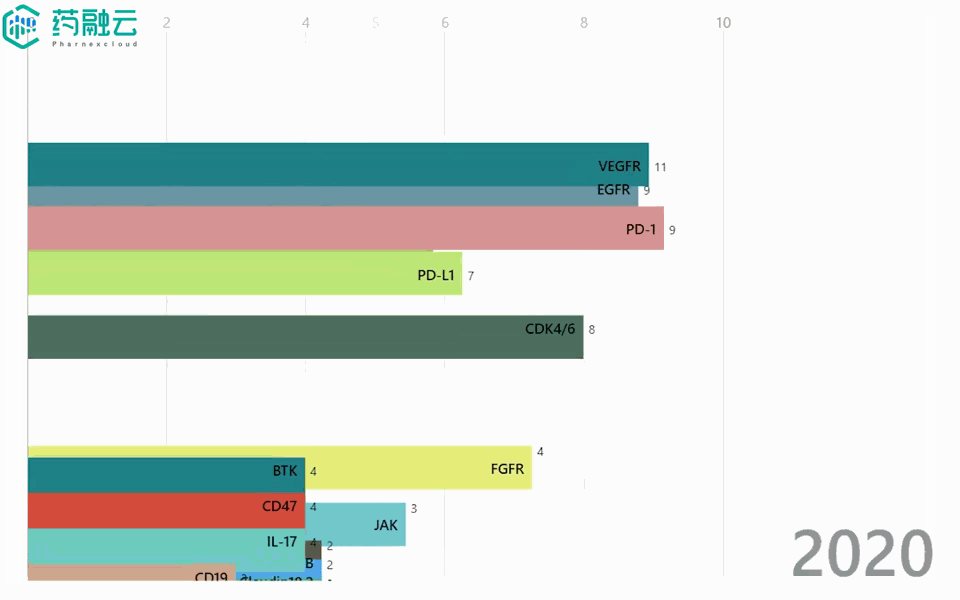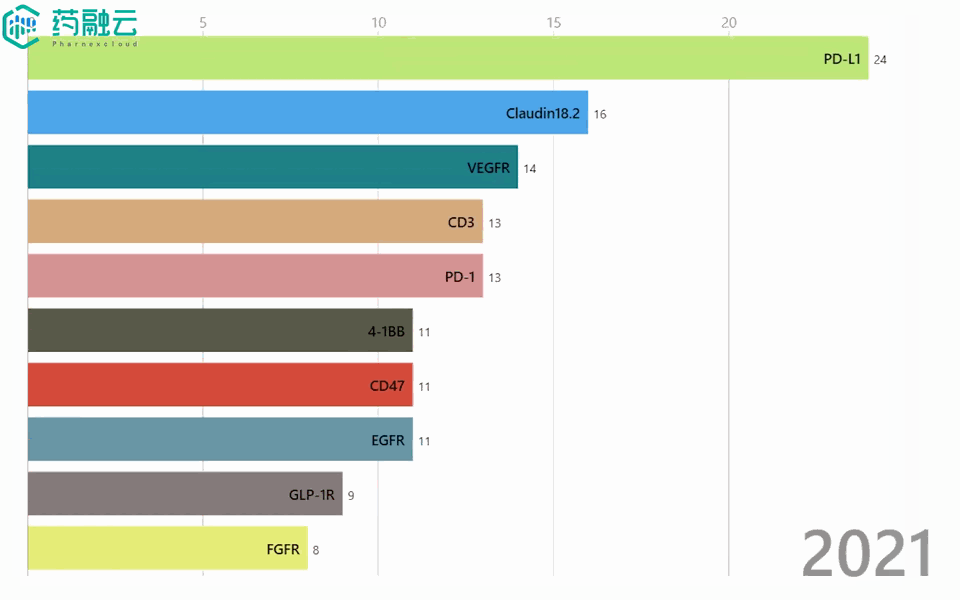
数据来源:中国 I 类新药靶点白皮书
然而,跟风研发是捕捉了风口,还是撞上了枪口,尚不可一概而论。对于部分药企而言,还要面临着“新药研发进度赶不上市场发展速度”的问题。面对大量未被满足的临床需求,率先上市的一批药品大概率享有更高的市场份额,后来者则很难在市场中多分一杯羹。PD-1药物的无限内卷便是真实写照。
国内PD-1药物研发格局(部分)

图片来源:中国 I 类新药靶点白皮书
本应享受生物创新药“高科技产物”的红利,在扎堆鏖战的境况下,上市后也不得不考虑控制成本。若在研药品进度在赛道上并不占优势,比起盲目追赶,或许及时止损不失为一种更好的选择。
试错成本高昂,牵一发而动全身
然而,不同于其他行业,新药研发本就是一项试错成本极其高昂的行业,周期长、投入大、风险高。一旦做出选择,后续便是资金、人力和时间的大额支出。
稍有不慎,无论是主动放弃止损、还是被动终止,数千万乃至数亿元的投入都将如石沉大海。亡羊补牢固然有效,但在新药立项之初,便能根据药企优势,选择最优的赛道和策略,从而节省后续测试的时间和金钱,才能从根源解决问题。
当下政策鼓励创新,但拒绝盲目跟风热门靶点,提倡差异化创新。对于创新药研发,要想跻身肿瘤、神经系统、感染、消化系统及代谢……等热门领域,并能充分发挥各自优势,药企应当如何进行靶点布局?
是选择走热门靶点best in class、还是潜力靶点first in class路线?对于正在研发进度止步不前的新药,是否需要及时后撤止损……这些无一不是药物立项、研发、上市路上必须要解决的问题。
数据在左,决策在右。然而,不少企业囿于手中有限的市场数据,而决策困难或失误,从而投入大量沉没成本。为了帮助探讨以上问题,我们借助药融云数据库,梳理了2016-2021年间国产I类新药申请受理情况、所涉及的靶点和最新研发进度;并对其进行分类统计,整理出热门靶点变迁史、近6年来各大治疗领域对应新药的靶点分布统计、5大热门靶点的最新全球研发进度;还以全球及中国创新药IND以上的靶点为基础,整理出最有潜力的「中国新」靶点……
最终,将以上内容编纂成为《中国 I 类新药靶点白皮书》,于本周三开始提供免费下载。此外,我们还将于1月11日(本周二)19:30-20:20,在药鼎记直播间与大家分享白皮书,一睹为快,诚邀各位医药人前来聆听,共同探讨中国创新药新机遇!等不及的朋友,可不要错过!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论