对于注射剂而言,制剂需要做临床配伍相容性研究,以确保产品在使用过程中安全有效质量可控。这部分资料需根据审评中心现行版《M4:人用药物注册申请通用技术文档(CTD)》的要求进行撰写,而80号文关于这部分正文书写要求也是一笔带过,那么临床配伍相容性资料究竟放在M4模块下哪一部分,并且该如何书写以达到审评中心的要求呢?本文作者将从已提交CDE申报的仿制药注射液项目为例与同行共同探讨书写方式。
撰写要点:
①临床配伍相容性研究属于模块三(3.2.P.1~3.2.P.3)中“3.2.P.2 产品开发”部分,根据作者提交CDE的资料,该部分内容放在了“3.2.P.2.6 相容性”项下。这部分应充分提供制剂与复溶稀释剂或(和)给药装置的相容性情况,从而为产品说明用法提供适当的数据支撑。
②联合用药的相容性研究以及不相容性稀释剂的信息也应在3.2.P.2.6中提供。
③注射液临床配伍相容性试验需根据产品临床使用说明书操作(参比制剂),在正文中列出详细的试验方案和结果,所用的分析方法如果与本申报资料“3.2.P.5制剂质量控制”分析方法不同,可作为本版块附件提交。
本文内容的介绍结合作者参与书写及申报的注射剂项目实战经验进行分享。涉及的剂型主要是小水针及大容量注射剂,包材涉及三层共挤袋、直立式聚丙烯输液袋以及玻瓶。
书写介绍开始:
1. 溶液配伍稳定性
①试验样品信息

备注:同一类配伍溶液最好选取市场上不同厂家的产品进行对比考察
②试验方案及研究结果
简述参比制剂说明书操作,研究结果见表3.2.P.2.6 -2
举例:配伍溶液1 (0.9%氯化钠溶液),其他不做赘述
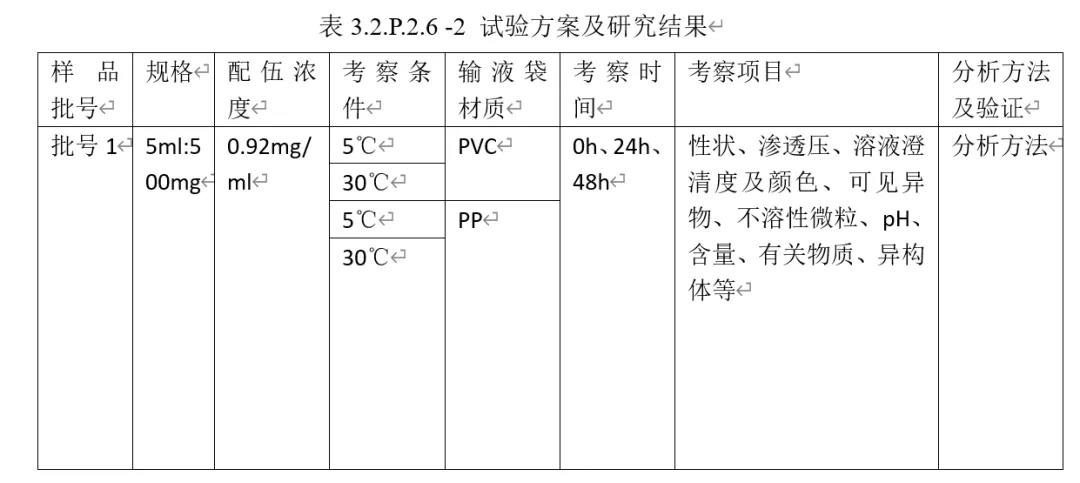
③结论
根据配伍试验结果,得出药物在一定时间的配伍稳定性结论,从而支持说明书的拟定。
2. 混合溶液稳定性
该部分内容针对大容量注射液(双腔或三腔),临用时需要挤压混合腔室内液体。
①试验样品信息

②试验方案及研究结果
根据参比制剂说明书内容操作。
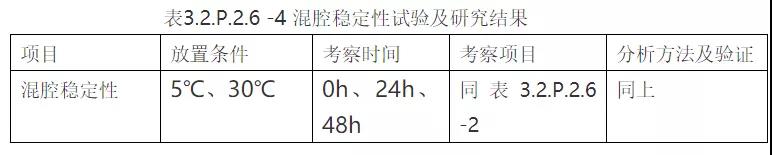
③结论
根据混腔稳定性试验结果,得出药物在一定使用时间的稳定性结论,支持说明书的拟定。
3. 给药器具的相容性
针对一些大容量注射液,滴注时间过长,可能会有输液器与药液不相容的风险。
①试验样品信息

②试验方案及研究结果
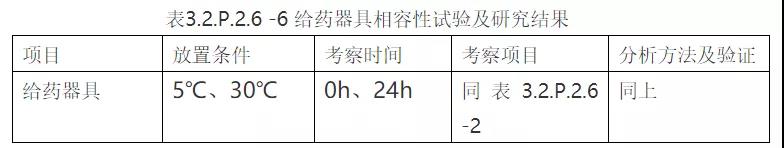
③结论
根据给药器具相容性试验结果,得出药物是否与给药器具相容。
4. 相容性研究数据汇总
①配伍稳定性数据;②混腔稳定性数据(小水针可不做)

备注:表中数据根据实验结果填写,考察项目可适当增减
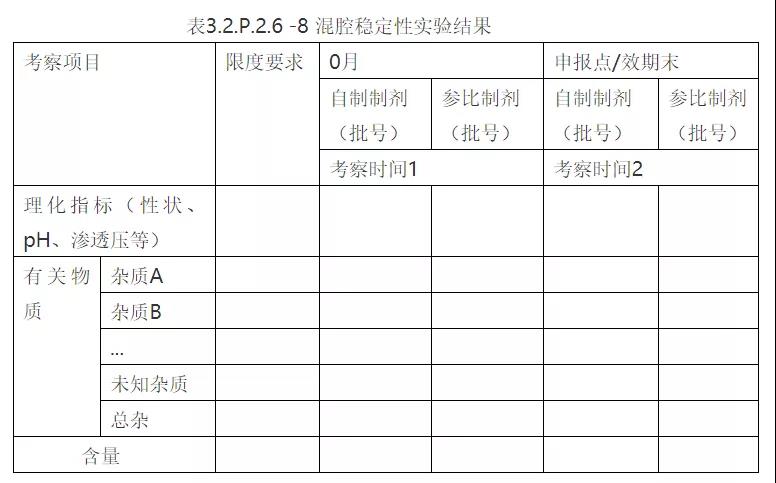
备注:表中数据根据实验结果填写,考察项目可适当增减
③给药器具相容性数据
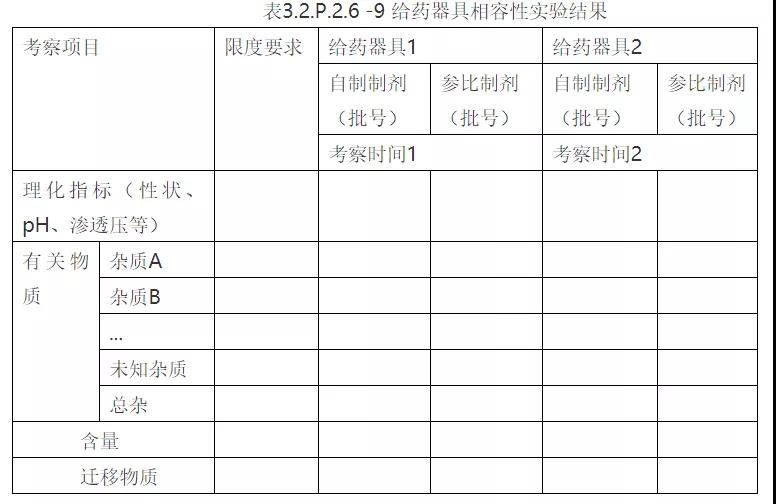
备注:①表中数据根据实验结果填写,考察项目可适当增减;②迁移物质这部分还应说明迁移量是否低于内控限度,通过最大日剂量计算各迁移物质的最大日摄入量,最大摄入量是否小于该迁移物每日最大暴露量(PDE),安全系数是否小于1%,从而证明给药器具相容性安全,且风险可控。同时迁移物质分析方法验证也应在该部分提交。
小结:临床配伍相容性研究是CTD申报资料必不可少的一项内容,该部分数据不仅为产品使用过程中质量安全问题提供了数据基础,也为说明书提供了适当的支持性信息,所以这部分内容思路清晰的撰写以及符合审评中心撰写要求就显得格外重要。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论