注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。
世界最贵药物TOP10,第一顺位基因治疗1396万元
2021年3月,美国互联网医疗企业GoodRx公布了最新一期的10大最贵年治疗费用药物排行榜。(统计为美国市场治疗费用,基本也是全球最贵之20款新药)
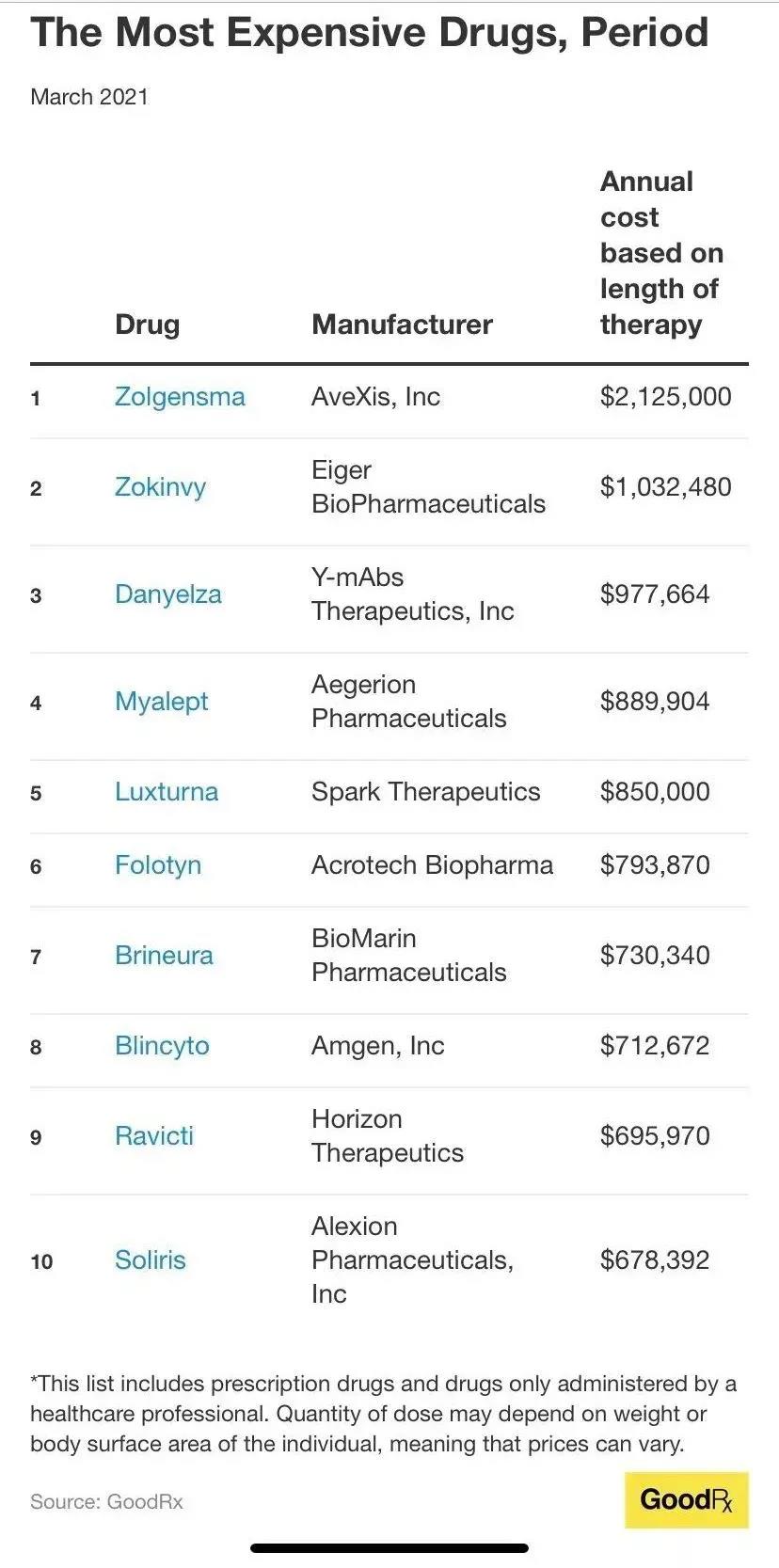
整体来看,该榜单主要以治疗肿瘤和或罕见病的药物为主,给国内制药行业一些新的引导。诺华(Novartis)旗下的脊髓性肌萎缩症(SMA)基因疗法药物Zolgensma以212.5万美元排在第一顺位。
Zolgensma

▲Onasemnogeneabeparvovec-xioi
诺华巨资收购的AveXis,公司核心产品脊髓性肌萎缩症(SMA,Spinal Muscular Atrophy)基因治疗药物,其定价为212.5万美元(一剂即可,一次性治疗方案),约合1358万人民币,是全球制药史上,目前为止最昂贵的药物。Zolgensma在美国于2019年5月上市,据药融云数据库来看,2019财年7个月销售额达3.61亿美元。2020年营收为9.2亿美元,同比增加150%。
数据来源:药融云FDA药品批准依据数据库
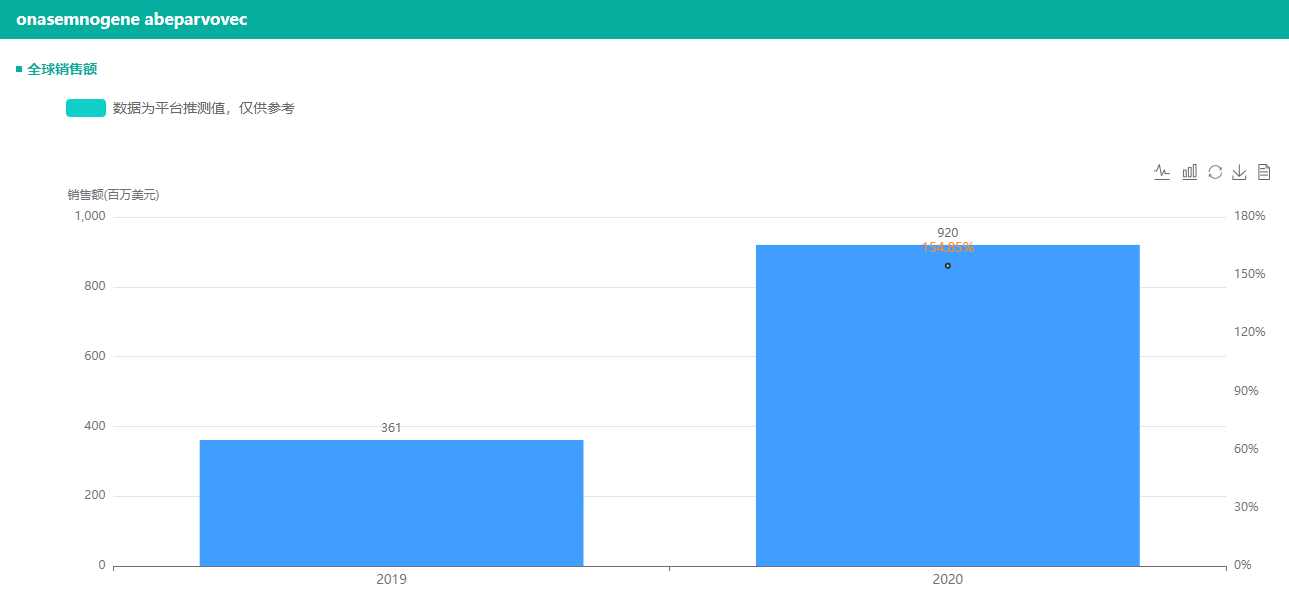
数据来源:药融云全球销售数据库
目前Zolgensma已经在全球近40个国家和地区获批。在美国市场,诺华和相关保险公司合作,患者家属可以分期5年来支付费用,平均每年42.5万美元。2020年5月,Zolgensma被纳入日本健保,患者只需支付30%费用;2021年3月Zolgensma被纳入英国国家医疗服务体系(NHS)。
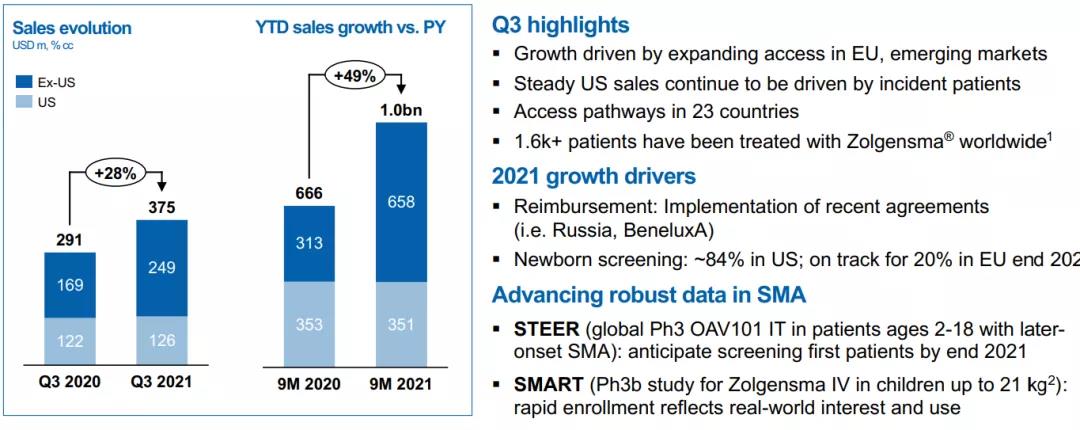
2021年,诺华第三季报显示,本品单季度业绩为3.75亿美元(其中美国市场1.26亿美元);前三季度合计10.09亿美元(其中美国市场3.51亿美元);已经成为重磅炸弹药物。
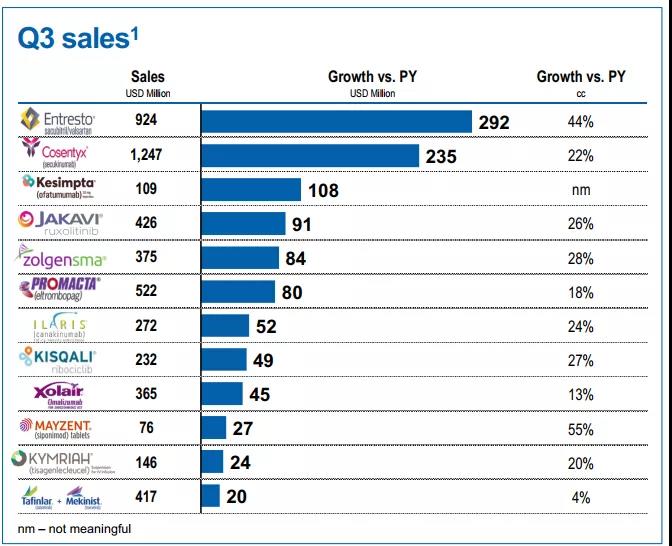
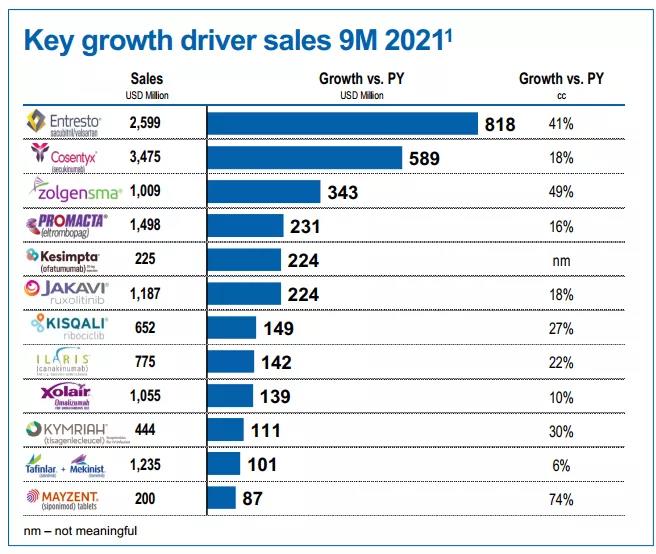
▲诺华2021前三季度和Q3主要产品业绩
2021年10月21日,诺华在中国递交基因疗法Zolgensma(onasemnogene abeparvovec-xioi,AVXS-101)OAV101注射液临床试验申请获得CDE受理公示,用于治疗脊髓性肌萎缩症(SMA)。
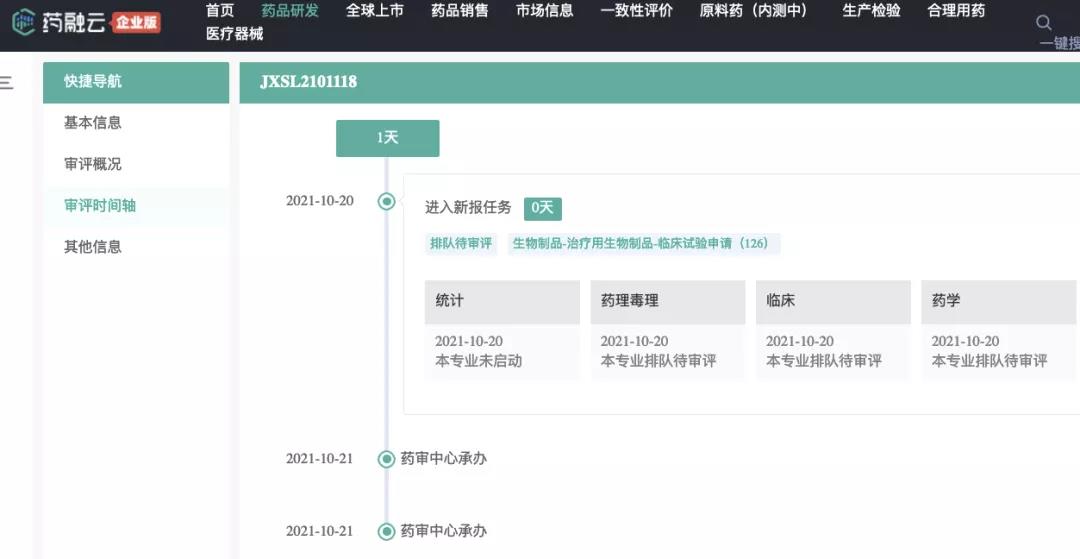 数据来源:药融云药品研发数据库
数据来源:药融云药品研发数据库脊髓性肌萎缩症
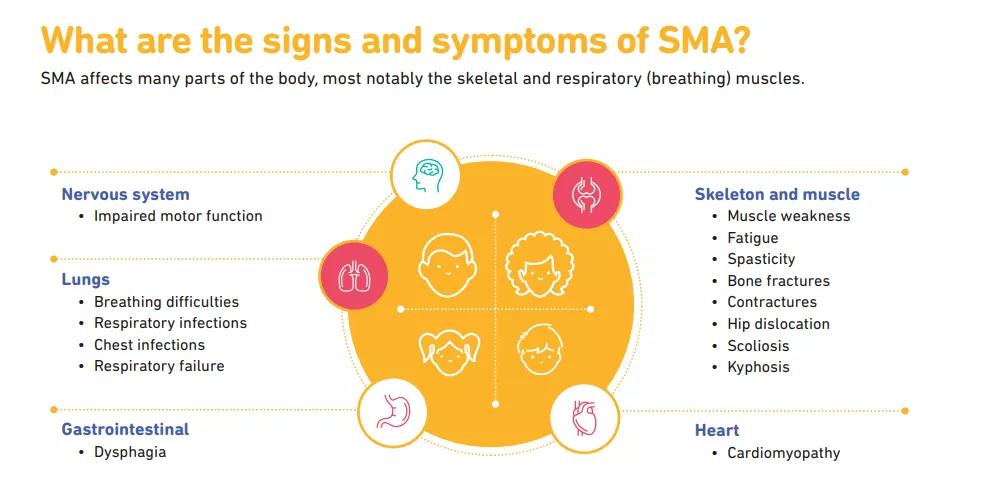
脊髓性肌萎缩(Spinal muscular atrophy, SMA)是一种罕见的常染色体隐性遗传性神经肌肉疾病,位于2岁以下儿童致死性遗传病的首位;主要发病原因是由于患者SMN1基因的缺失或突变,导致全身功能性SMN蛋白表达不足。该疾病以脊髓和下脑干中运动神经元的丢失为特征,从而导致严重的、进行性肌肉萎缩和无力。最终,SMA患者可能丧失行走能力,并且难以完成呼吸和吞咽等基本生活功能,从而导致重大的医疗干预和护理帮助。如果不进行治疗,大多数患有严重疾病类型的婴儿在没有呼吸干预的情况下,无法活到两岁。
2018年5月SMA被纳入国家《第一批罕见病目录》。2019年《脊髓性肌萎缩症多学科管理专家共识》推出,2020年《脊髓性肌萎缩症遗传学诊断专家共识》推出。目前国内获批的SMA相关新药有:诺西那生钠注射液(英文商品名Spinraza®)、利司扑兰口服溶液用散(英文商品名Evrysdi®)。
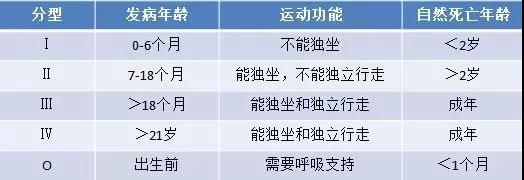
▲SMA疾病分型
2020年8月发布的《中国SMA患者生存现状白皮书》报告显示,对于病情最为严重的1型SMA患者,2016 年之前出生的1型SMA患者,从发病开始,人均需要 6.6 个月才能获得确诊;而2016 年之后出生的1型SMA患者,其确诊时间需要3.5个月。多位医学专家呼吁:在用药可及性大幅提升的情况下,SMA的早诊早治、多学科管理和康复训练,已成为延缓疾病进展的关键。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
各公司披露信息;等等。
https://www.goodrx.com;
https://www.novartis.com;
https://www.novartis.com/investors/event-calendar;
https://medlineplus.gov/spinalmuscularatrophy.html;
https://www.mda.org/disease/spinal-muscular-atrophy;
脊髓性肌萎缩症多学科管理专家共识[J].中华医学杂志,2019,99(19):1460-1467.;
Kolb SJ and Kissel JT. Spinal muscular atrophy. Neurol Clin. 2015;33:831-46;
Cure SMA. About SMA. 2018. Available from: http://www.curesma.org/sma/about-SMA/.Accessed March 2019;等等。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论