注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。
概 况
随着制药工业的迅猛发展,以发酵法生产、不对称催化和连续流为代表的绿色制药越来越受到追捧。发酵法制酶和发酵法生产原料药是原料药生产工艺的重要方式之一,发酵法生产的原料药主要包括氨基酸类和抗生素类以及一些生物制品等,其中抗生素类又包括青霉素盐、四环素盐、红霉素类、链霉素、庆大霉素等氨基糖苷类原料药。它们通常是通过发酵和化学合成结合的半合成方式得到的。由于发酵法制酶和发酵法生产的技术特异性,部分原料药采用发酵法制酶和发酵法生产原料药后的成本远远低于全合成的,这也使一些制药企业将该类产品获得国家集采提供了产品基础,甚至一些企业以发酵法制酶和发酵法生产原料药技术形成了核心竞争力并能在价格上碾压竞争对手。与全合成的原料药不同的是,发酵法制酶和发酵法生产原料药在普通原料药基础上增加了发酵过程的优势,但同时因发酵过程副产物多,存在酶或细胞组织残留在原料药中的可能性,这样也增加了发酵法制酶和发酵法生产原料药品注册难度。本文主要浅谈发酵法制酶和发酵法生产原料药的注册要点,给同行一些启发,以期抛砖引玉,帮助一些同行尽快完成发酵法制酶和发酵法生产原料药的全球申报注册工作。
发酵法制酶和发酵法生产原料药的注册要点
1、 申报资料中的发酵法制酶和生产原料药工艺描述
1894年,美籍日本人高峰让吉从米曲霉中制备得到α-淀粉酶开创了酶生产和应用的先例。随着人类对酶生产的进一步认识和发展,现已能从动、植物提取和微生物发酵得到酶。现如今原料药发酵过程所用到的微生物来源的酶一般制备流程见下图。

作为原料药生产工艺的一部分,发酵法制酶和发酵法生产原料药两个过程均必须遵照执行相应的GMP基本条款,如ICHQ7的第18章节和中国GMP2010年版附录原料药中第10章采用传统发酵工艺生产原料药的特殊要求。GMP基本条款中提出的要求同时是申报资料中的工艺描述重点。
发酵法制酶生产工艺申报资料中至少但不仅限于以下信息。1).菌种 菌种的名称、来源和鉴别。若是自制的,那菌种的采集,富集培养,分离,初筛和复筛过程需要描述完整。涉及传代接种的,应说明传代次数和过程,菌种浓度等。菌种采取斜面、沙土管、真空冷冻干燥、低温、石蜡油等存储方式中的哪一种方式以及存放时间周期应提交。当然,菌种的制备、过程控制、使用、定期监测活性、储存等管理涉及到的微生物实验室设施设备、人员、管理制度等现场情况必须符合相关GMP和微生物安全要求并有记录支持以备现场检查。2).培养基 培养基的名称、批号、组分、浓度或配比和配制过程。培养基的灭菌方法和验证情况。主要成分的质量标准和测试方法等等。3).菌种的发酵条件和控制 a.pH值 酶合成的最适合pH值(注:与酶生长最适合的pH值可能不同)和如何调节(是否改变培养基组分或比例,是否使用缓冲液、是否加入适宜的酸或碱等);b.温度 发酵产酶最适合的温度值(同样不一定是酶最适合生长的温度)和发酵罐或生物反应器如何通过冷水、热水或其他方式调节温度;c.溶解氧 氧气/空气通入量和氧气/空气分压力,气体与液面的接触时间和面积,培养液的温度和粘度值(是否采用措施降低粘度,是否采用消泡剂处理)等等。酶的分离和纯化过程以及酶的收率等等。
酶使用工艺申报内容至少包括但不仅限于下述内容。生产步骤中主料、酶、溶剂、试剂和辅助材料的化学或生物名称以及数量和投料顺序;使用的设备的种类(例如发酵罐,纳滤仪)和如何清洗消毒,如果该设备对生产或控制比较关键同时应注明材质;所有工艺控制相关的温度、压力、pH值、时间、混合速度等数值范围或标准;IPC和IPC采用的分析程序描述,例如HPLC或TLC;去除酶残留的纯化和精制步骤如超滤、纳滤等;本步骤的产率范围(重量和比率)等等。
非发酵工艺部分的申报内容可按照2021年7月19日CDE发布的《中药、化学药品及生物制品生产工艺、质量标准通用格式和撰写指南》的通告编写。
2、 杂质和微生物的控制
发酵法制酶和发酵法生产的原料药有其特殊性,体现在发酵生成的是同系物(都是有效成分)和副反应杂质多且难以分离提纯。因此这类原料药的质量标准可能同全合成的有较大区别,特别是一些抗生素,无法有含量来表述质量情况而采用效价代替。一些常见发酵原料药药典标准中的有关物质和含量指标见下表。
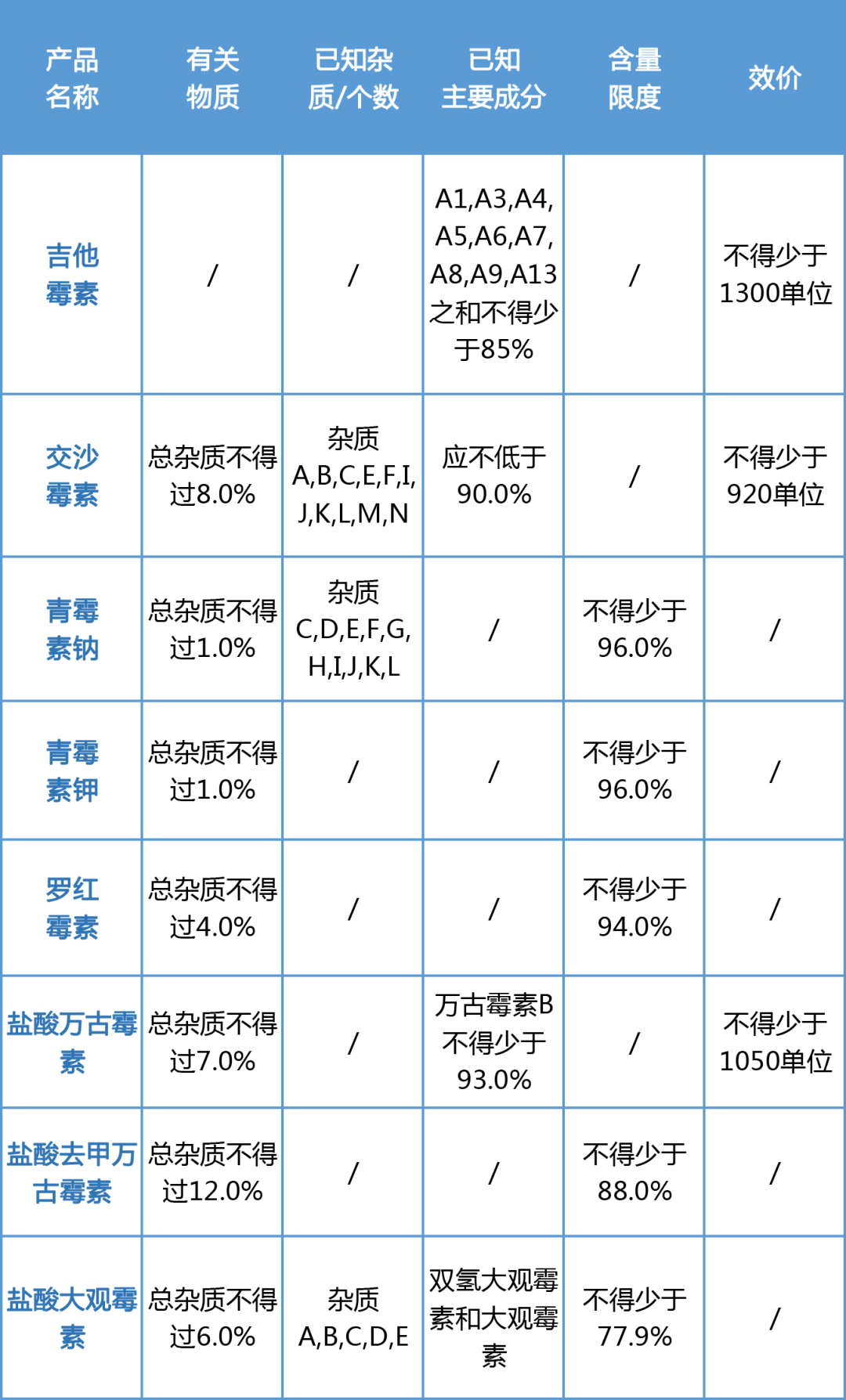
对于这类原料药申报质量标准的制定,应从以下几个方面考虑:1).研发过程中从理论上分析可能产生的杂质和主成分同系物,并考虑在制备分离基础上对多数批次中均含有的且大于0.1%的色谱峰进行分离鉴别,同时结合临床实验和药理毒理实验确定是有效的主成分同系物还是杂质。2).若是仿制药,尽量查询原研药的资料和文献,尽量将产品质量向原研药靠齐,避免制定的太宽松不被批准,反之标准太严增加研发和生产的难度。
另一方面,酶的生产和采用酶生产原料药的过程中应在微生物学方面制定防止微生物污染的措施,将生产要求的环境、生产设备的清洁和消毒以及酶的灭活进行详细的描述和处理,同时应对环境、清洁、消毒和灭活的程序进行验证,用科学数据支持操作规程达到了实际效果。特别在适当的生产阶段如物料暴露工序还应进行微生物负载和外源微生物的监控,并考虑产品进行细菌内毒素监测。
3、 酶和细胞组织残留处理
即使研发部和生产部能从理论上解释清楚发酵法制酶和发酵法生产原料药在制备分离提纯工序能保证酶和细胞组织可以被完全去除,但发酵法制酶和发酵法生产原料药中仍然存在残留酶和细胞组织的风险。因此在注册审报资料中必须考虑它们的传递和去除问题且采用数据来进行支持。笔者一朋友在2021年6月就收到CDE的发补函,要求提供原料药中酶的残留情况的数据证明。
酶和细胞组织的残留的解释确实是发酵原料药申报的要点之一。笔者在申报发酵法制酶和发酵法生产原料药时,通常会进行如下处理。1).由研发人员从生产工艺的角度解释如何经过分离、超滤、纳滤等步骤将酶和细胞组织除去的;2).委托专业的酶测试研究所(比如浙江湖州某蛋白质研究所)针对本原料药生产用酶和细胞组织开发专用的测试试剂,并对开发的试剂进行专属性、精密度、线性、准确度、检测限和定量限、耐用性等项目进行方法学验证;3).采用验证后的特异性方法对上述步骤的中间体、滤液和成品进行酶和细胞组织的定量测试,通过测试的数据支持酶和细胞组织的在生产过程中的传递过程以及成品中的残留量(笔者最近一次提交资料中酶和细胞组织的检测限达到0.05ppm,原料药中结果为未检出)。这些资料应在基线文件中的杂质章节进行论述,以论证发酵法制酶和发酵法生产原料药中没有被酶或细胞组织污染。
结 语
发酵法制酶和发酵法生产原料药生产企业作为责任主体,如何利用好最了解自己的产品和其生产工艺的优势,顺利完成产品申报获得注册批件。注册策略简单来说,可将酶作为原料药生产的特殊起始原料进行全面的质量控制,同时考虑酶使用在工艺过程会产生的杂质及其本身的传递过程;另一方面将酶使用的的特殊环境和发酵工艺步骤和质量控制描述清楚。只要发酵法制酶和发酵法生产原料药中有关酶的控制处理科学合理且有真实可靠的数据支持,能说服企业内部质量人员,那么审批科学家也就很难提出大的发补意见,生产企业获得注册成功同样是指日可待了。
编者:因本人水平有限,多有不当之处提请读者指正和包涵。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论