以色列梯瓦制药公司(TEVA Pharmaceutical Industries Limited,TEVA)成立于1901年,是全球著名的跨国企业,也是世界上最大的仿制药公司之一。梯瓦专注于中枢神经系统、呼吸系统疾病和肿瘤学领域的治疗,致力于开发及生产优质非专利药物(仿制药)、创新的专科药物及药物活性成分(APIs)。其使命是成为仿制药和生物制药的全球领导者,以改善患者的生活。

目前,梯瓦拥有超过3500种药物的产品组合,在30多个国家和地区拥有68个制造工厂,每年生产约850亿片药片与胶囊以及10亿剂注射药物。每天,梯瓦的药物治疗世界各地约2亿人。同时,梯瓦也是世界卫生组织基本药物目录(EML)中药物的主要供应商。
一、业务分部
1、北美市场
梯瓦的北美业务分部包括美国和加拿大。作为在美国领先的仿制药公司,梯瓦销售500多种非专利处方药产品,包括口服固体制剂、注射制剂、吸入制剂、液体、软膏和乳膏,剂型、包装尺寸和形式超过1500种。在美国,梯瓦的大部分仿制药销售对象是零售连锁药店、邮购分销商和批发商。
在北美,梯瓦的专科药物组合主要涵盖三个领域:中枢神经系统(CNS)和疼痛、呼吸系统以及肿瘤学。公司CNS产品组合包括用于成人偏头痛的预防治疗的AJOVY®(fremanezumab)、用于治疗神经退行性病变和运动障碍的AUSTEDO®(氘代丁苯那嗪,全球首个氘代新药),还有COPAXONE®(醋酸格拉替雷注射剂)自推出以来,在近25年时间里,它仍然是北美地区用于治疗多发性硬化症(MS)的主要产品之一。
2、欧洲市场
梯瓦的欧洲业务分部包括欧盟和其他一些欧洲国家。在欧洲,梯瓦是三大仿制药企之一,尽管欧洲市场充满多样性和高度的分散性,客户整合率低于美国,但是其中仍然有一些共同的特点,使梯瓦能够利用其泛欧洲存在和广泛的投资组合。梯瓦在欧洲的投资组合包括SUDOCREM®等全球品牌,以及德国的NasenDuo®和波兰的Flegamina®等地区品牌。
在欧洲,梯瓦的专科药物组合也包括三个领域:中枢神经系统和疼痛(包括偏头痛)、呼吸以及肿瘤。尽管欧盟的各个市场正在引入新的治疗方法,梯瓦的拳头产品COPAXONE(醋酸格拉替雷注射剂)仍然是治疗多发性硬化症的主导产品之一。AJOVY(fremanezumab)于2019年获得欧盟营销授权(MAA),截至2020年12月31日,梯瓦已在大多数欧洲国家推出AJOVY。
3、国际市场
除了北美和欧洲的业务分部,梯瓦的国际市场包含了超过35个国家,占全球医药市场的很大一部分。梯瓦的主要国际市场是日本、俄罗斯和以色列。
在日本,梯瓦通过与武田制药合资(JV)来经营大部分业务,梯瓦持有51%的股份,武田持有剩余的49%。2021年2 月1日,梯瓦完成了在日本的业务合资公司大部分仿制药和运营资产的出售。梯瓦的国际业务分部国家包括高度管制的纯仿制药市场,如以色列;品牌仿制药为导向的市场,如俄罗斯;和某些拉丁美洲市场;以及混合市场,如日本。每个市场的战略都是建立在差异化和填补市场未满足的需求之上。梯瓦在国际市场的专科药物组合仍然包括:中枢神经系统和疼痛、呼吸以及肿瘤三个领域。
二、经营状况不乐观,资产进一步缩水
2021年2月10日,梯瓦制药(Teva)披露2020年财报。该公司的全年总收入从2019年的168.87亿美元降至2020年的166.59亿美元,同比下跌1.35%,这是2018年以来的第三次下滑。归母净利润为-39.90亿美元,同比下降299.4%,这是2017年以来第四次归母净利润为负。同时,梯瓦也在继续进行成本控制,其销售成本、研发成本、营销成本分别降至89.33亿美元、9.97亿美元、24.98亿美元。具体运营数据如下:

图源:TEVA
另外,公司的资产状况也不容乐观,据财报显示,2020年,虽然梯瓦的总负债从2019年的269.08亿美元降至259.19亿美元,但总资产继续缩水,降至506.40亿美元。具体资产负债表数据如下:

图源:TEVA
三、市场竞争激烈,多种风险并存
财报还披露了目前梯瓦面临的风险因素:
关于公司的市场竞争能力风险,梯瓦的仿制药业务占了很大一部分,该业务持续面临来自全球制药同行的风险;由于客户基础和客户之间的商业联盟的持续巩固,仿制药产品的销售可能受到不利影响;其他药企的竞争和监管政策的变化,也会导致仿制药的收入和利润下降;部分新的非专利产品的推出已经延误,并且可能继续延误;越来越多的竞争对手瞄准仿制药机会,并寻求重要产品仿制药(generics)版本的美国市场独占权,可能会对梯瓦的收入和利润产生不利影响;公司可能无法很好地利用高价值生物药的机会;专业药品面临着来自拥有更大资源和能力的公司的激烈竞争。
关于梯瓦的巨额负债风险,截至2020年12月31日,梯瓦背负着259.19亿美元的巨额债务,增加了支出,限制了公司承担额外债务或从事其他交易的能力,同时,梯瓦在未来可能还需要筹集额外的资金;如果主要评级机构将公司的信用评级进一步下调,梯瓦可能无法以对公司有利的金额或条件进行借款。
关于业务与运营相关的风险,任何公共卫生危机,疾病或其他传染性疾病的广泛爆发,如COVID -19,可能对梯瓦的业务产生不利影响;工作实施情况、关键人才聘用、制造或质量控制问题、供应链中断或内部或第三方信息技术系统问题、数据安全漏洞都可能对公司的业务产生不利影响;梯瓦的公司分布在世界各地,不同的知识产权法将影响不同分部的生产;广泛的药物监管、医疗改革、药品定价、报销和覆盖范围也可能影响公司的业务;公司还可能会决定出售资产,这可能会对梯瓦的前景和增长机会产生不利影响。
四、“减负”进行时,新药带来机遇
2021年4月28日,梯瓦公布2021年第一季度财务业绩(Q1),公告显示,公司2021年第一季度归母净利润为7700.00万美元,同比增长11.59%;营业收入为39.82亿美元,与2020年第一季度相比,同比下跌8.61%。
这主要是由于梯瓦欧洲分部的非专利产品、非处方药和呼吸道产品以及多发性硬化症药物Copaxone(醋酸格拉替雷注射剂)的收入减少;北美分部的Copaxone(醋酸格拉替雷注射剂)和BENDEKA/TREANDA(盐酸苯达莫司汀)的收入减少;梯瓦在日本的的大部分非专利和运营资产被剥离,以及在日本的专利产品的监管价格下降和仿制药竞争,也影响了梯瓦在日本的业务,但这部分被北美分部的非专利产品和亨廷顿治疗药物AUSTEDO(氘代丁苯那嗪)收入的增加所抵消。此外,第一季度收入也受到新冠肺炎大流行影响,导致的某些产品需求产生变化。按活动和地理区域划分,具体产品业绩如下:
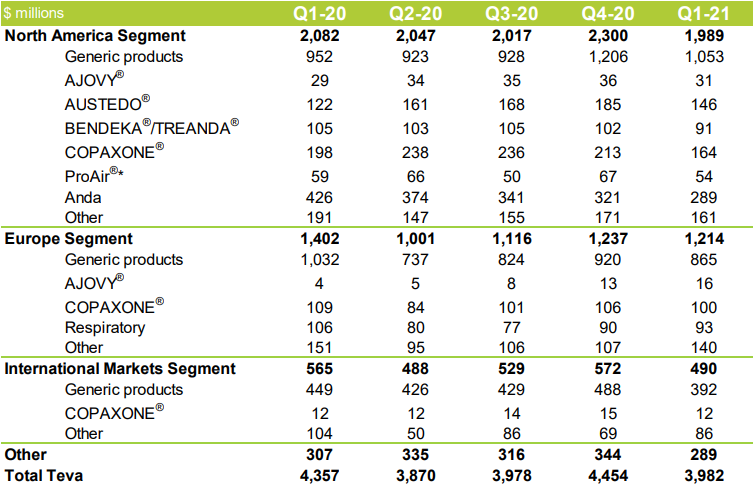
图源:TEVA
另外,梯瓦也在持续“减负”,其净债务减少到了232亿美元。对此,Teva总裁兼首席执行官Kåre Schultz先生表示:“我们提高了盈利能力,并将我们的净债务减少到232亿美元。一些主要产品也表现强劲:生物类似药(biosimilar)Truxima®(利妥昔单抗)的市场份额提高到了26%,AUSTEDO®(氘代丁苯那嗪)的业绩继续保持增长,AJOVY®(fremanezumab)巩固了其在美国的市场份额,并在欧洲继续扩张。我们正处于这样一个阶段,Copaxone®(醋酸格拉替雷注射剂)的损失现在正被AJOVY®(fremanezumab)、AUSTEDO®(氘代丁苯那嗪)和生物类似药的增长所平衡。基于我们的业绩和对今年剩余时间的预期,我们正在重申指导方针。”.

Kåre Schultz 图源:TEVA
五、最新研发管线
根据药融云数据(www.pharnexcloud.com)与梯瓦官网公布的最新研发管线,公司目前共有28个在研项目。适应症包含偏头痛、精神分裂症、胃肠道疾病、运动障碍、炎性疼痛、呼吸系统疾病、肿瘤学等。其中,处于临床前研究阶段的有13项、临床I期阶段有4项、临床II期3项、临床III期阶段4项。此外,处于预提交阶段的有3项,已接受监管审查的有1项。所有在研项目类型中,生物类似药占比最高,有11项,其次是新型生物制剂10项,还有小分子药物5项,吸入药物2项,具体管线分布如下:

图源:TEVA pipeline
其中,梯瓦与冰岛生物制药公司Alvotech共同研发的HUMIRA(阿达木单抗)的生物类似药已接受监管审查。HUMIRA(阿达木单抗)是美国制药公司艾伯维的一款生物制剂,是全球首个获批上市的全人源抗肿瘤坏死因子ɑ(TNF-ɑ)单克隆抗体,其适应症有类风湿性关节炎、强直性脊柱炎、斑块状银屑病、克罗恩病等。
目前,在美国HUMIRA(阿达木单抗)每支注射器售价高达2984美元,比该药上市时涨了470%,2018年,HUMIRA(阿达木单抗)每支在中国销售价高达7000元(40mg/0.8ml),一年的用药费用接近20万元,这对于患者来说是一笔沉重的医疗负担,目前最新价格非常优惠,中国市场或将很快实现阿达木单抗生物药的集采。因此,如果该药的生物类似药获批上市,则将大大降低治疗成本,为患者及其家庭减轻负担。
Prolia(地诺单抗)是由安进公司研发的一种治疗骨质疏松的药物,是首个获批的特异性靶向RANK 配体的单克隆抗体。RANK配体是破骨细胞维持其结构、功能和存活所必需的一种跨膜或可溶性的蛋白。目前,梯瓦也正在开发Prolia(地诺单抗)的生物类似药,且已进入Ⅲ期临床试验。
为了应对仿制药的激烈竞争,梯瓦也在布局创新药物的研发,例如,梯瓦与再生元共同开发的Fasinumab(法司努单抗),该药是一种人源化的神经生长因子(NGF)单克隆抗体,用于治疗骨关节炎疼痛,目前正处于Ⅲ期临床试验。
AJOVY®(fremanezumab)是一种可与降钙素基因相关肽(CGRP)结合并阻断CGRP与其受体(CGRP-R)结合的人源化单抗,可用于治疗偏头痛,最初由美国公司Rinat Neuroscience(2006年被辉瑞收购)研发,代号是RN307。2012年辉瑞将RN307卖给名为Labrys Biologics的新公司,2014年Teva又收购了Labrys,最终获得fremanezumab。目前,梯瓦正在积极拓展该药的适应症,其用于治疗肌纤维痛的研究已进入Ⅱ期临床试验。
此外,还有亨廷顿治疗药物AUSTEDO®(氘代丁苯那嗪),该药是一种靶向囊泡单胺转运体2(VMAT2)的小分子口服抑制剂,其针对运动障碍型脑瘫的研究也已进入Ⅲ期临床试验。
六、最新动态
2021年5月17日,梯瓦制药的美国子公司TevaPharmaceuticals宣布在美国推出第一个THIOLA®(硫普罗宁)的仿制药,该药用于治疗胱氨酸尿症。这是一种罕见的遗传性疾病,可导致尿中胱氨酸水平升高,导致反复出现的胱氨酸肾结石的形成。
2021年5月4日,梯瓦制药的美国子公司TevaPharmaceuticals宣布推出250毫克和500毫克规格的普通红霉素片,该药是参考上市药物(RLD )Arbor公司红霉素片的等效产品。
2021年5月4日,欧洲金融公司UBS将梯瓦制药评级从买入下调为中性。目标价从15.00美元下调至11.00美元。
2021年4月29日,梯瓦制药的美国子公司TevaPharmaceuticals宣布推出第一个可用的10毫克、20毫克、25毫克、30毫克、35毫克和40毫克规格的普通版Absorica®(异维A酸胶囊),用于严重顽固性结节性痤疮。
2021年4月28日,梯瓦制药首席执行官KareSchultz表示,该公司不太可能与COVID-19疫苗生产商达成合作生产疫苗的协议。
七、主要发展历程
1901年
梯瓦在耶路撒冷由查姆·所罗门(ChaimSalomon),莫西·莱文(MosheLevin)和伊沙克·埃尔斯坦(YitschakElstein)三位药剂师共同建立,在当地用骡及骆驼车队在全国各地分销进口药物,最初被称为Assia。
1948年
以色利政府成立后,以色列的医药市场稳定发展,梯瓦开始出口自己的产品。
1976年
Assia与梯瓦和Zori两家制药公司合并,成立了以色列最大的医疗保健公司——梯瓦制药工业有限公司。
1986年
梯瓦收购了美国宾夕法尼亚州的仿制药公司列蒙。
2001年
获得了马瑞恩的所有权。这两次并购是梯瓦发展史上的重要转折点,对其立足美国市场、在销售生产等多方面起到举足轻重的作用。
2004年
梯瓦斥资34亿美元收购Sicor,从而进入生产仿制药注射剂的生物类似药领域。
2005年
以74亿美元大手笔收购Ivax,梯瓦成功跻身于世界第16大处方药销售制药公司。
2006年
梯瓦全球销售收入预计将超过80亿美元,其中80%的销售额来自北美和欧洲。美国梯瓦公司(TevaPharm Usa)成为当年全美国处方量最多的公司,多达4.22亿张,占美国处方量的比重已超过10%,远高于第2位的辉瑞公司。
2008年
梯瓦收购全球第四大仿制药品生产商Barr。该收购进一步巩固TEVA在美国的领导地位,同时将大力强化其在欧洲和中东欧主要市场的地位。
2010年
梯瓦宣布以50亿美元的价格收购德国大型仿制药生产企业Ratiopharm公司,此举将使梯瓦进一步巩固其在仿制药行业的龙头地位。
2016年
梯瓦以400亿美元收购竞争对手Allergan的仿制药相关业务后,梯瓦制药一直背负着巨额债务,裁员是该公司大型重组计划的一部分。
2017年
用于治疗与亨廷顿病(HD)有关的舞蹈病及成人迟发性运动障碍(TD)的创新药物安泰坦®(氘丁苯那嗪片)获得美国FDA批准,是FDA首次批准的氘代产品,也是历史上第二个针对亨廷顿病有关的舞蹈病的药物。
2019年
用于适用于治疗在利妥昔单抗或含利妥昔单抗方案治疗过程中或者治疗后病情进展的惰性B细胞非霍奇金淋巴瘤(NHL)的全新药物存达®(注射用盐酸苯达莫司汀)在中国上市。该药物于2018年12月获得国家药品监督管理局批准。
2020年
安泰坦®获得中国国家药品监督管理局(NMPA)批准。用于治疗与亨廷顿病(HD)有关的舞蹈病及成人迟发性运动障碍(TD)。
八、总结
120年前,梯瓦在以色列耶路撒冷由3位药剂师建立,是全球底蕴深厚的仿制药一哥,可以说,其发展历史也是行业的缩影。仿制药的打法是由规模/研发效率等主导的,因为仿制药不享受专利药的市场溢价,仿制药企赚大钱的方式只能是“薄利多销”。虽然,梯瓦通过大量的并购交易,不断扩展业务管线,但是近几年,频繁并购所留下的债务也给梯瓦带来不小压力。把鸡蛋放在不同的篮子里是有道理的,在仿制药业务不景气的时候,梯瓦的创新药物能否“挑起大梁”,以及能否不断推陈出新,考验着企业应对风险的各方面能力。未来,梯瓦的经营不会变轻松,但是公司的体量大,也不会轻易倒下,梯瓦现在所面对的也是所有仿制药企将要面对的,能否审时度势,实现转型,将决定着企业的命运。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论