【10月全球在研新药与靶点月报-内容亮点】
10月国内新药获批临床情况
- 10月共有122款新药获批临床;
- 较上个月减少了58款,其中包括49款化药,70款生物制品,3款中药;
- 10月数量最多的新药为抗肿瘤药和免疫机能调节药物,有106个;
- 10月消化系统与代谢药物获批数量也比较多,有31个
全球获孤儿药/突破性/快速通道资格认定品种盘点
- 10月共有66款药物获孤儿药/突破性/快速通道资格认定品种。
全球在研创新药积极/失败临床结果最新动态速递
- 辉瑞公布小分子组合疗法的3期临床数据;
- 礼来抗IL-23抗体治疗克罗恩病3期结果积极;
- 优时比公布Bimzelx的3期临床结果;
- 安进OX40靶向单抗rocatinlimab治疗特应性皮炎3期结果积极。
每月相关创新药最新政策速递、国内新药注册申报、全球获孤儿药/突破性/快速通道资格认定品种盘点、全球在研创新药积极/失败临床结果TOP20、全球创新药研发进展TOP20等,摩熵咨询团队基于真实可溯源的全球医药数据,将每月推出「全球在研新药月报」,以期帮助业内人士通盘把握每月全球范围内的新药开发情况,全面而深入的了解全球新药开发动态。
一、10月国内新药获批临床/上市情况
根据摩熵数据统计,2024年10月共有122款新药获批临床(共计208个受理号),较上个月减少了58款,其中包括49款化药,70款生物制品,3款中药。

截图来源:摩熵咨询月报
本月获批临床受理号数量最多的新药为抗肿瘤药和免疫机能调节药物,有106个,占比为51%,消化系统与代谢药物获批数量也比较多,有31个。获批剂型主要为注射剂与片剂,分别有114个,63个。
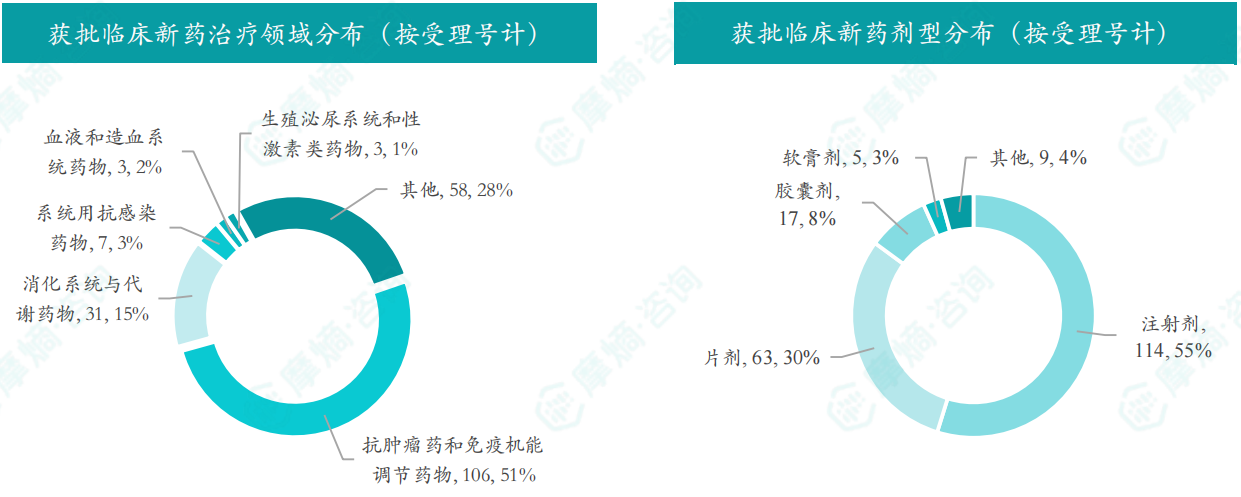
截图来源:摩熵咨询月报
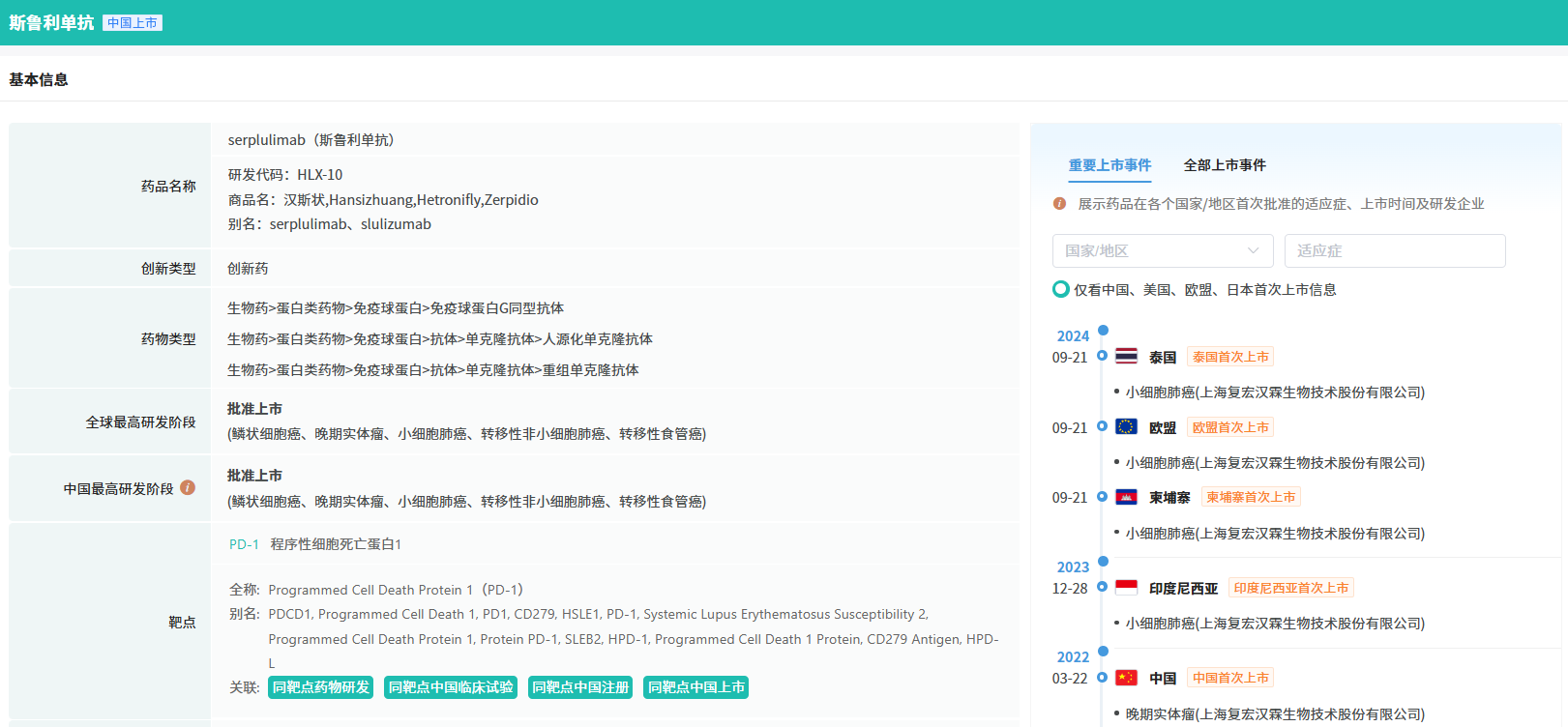
在10月份,国内医药市场迎来了6款创新药物的获批上市,涉及齐鲁制药的艾帕洛利托沃瑞利单抗注射液,既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者。还有更上海君实生物医药、康融东方(广东)医药等多家药企均迎来新的进展。

截图来源:摩熵咨询月报
二、全球获孤儿药/突破性/快速通道资格认定品种盘点
10月共有66款药物获孤儿药/突破性/快速通道资格认定。10月3日,阿斯利康宣布,为布鲁顿氏酪氨酸激酶(BTK)抑制剂Calquence(acalabrutinib)递交的补充新药申请(sNDA)已经被美国FDA接受并授予优先审评资格,用于治疗初治套细胞淋巴瘤(MCL)成人患者。
10月本月全球孤儿药/突破性/快速通道资格认定品种(部分)一览表
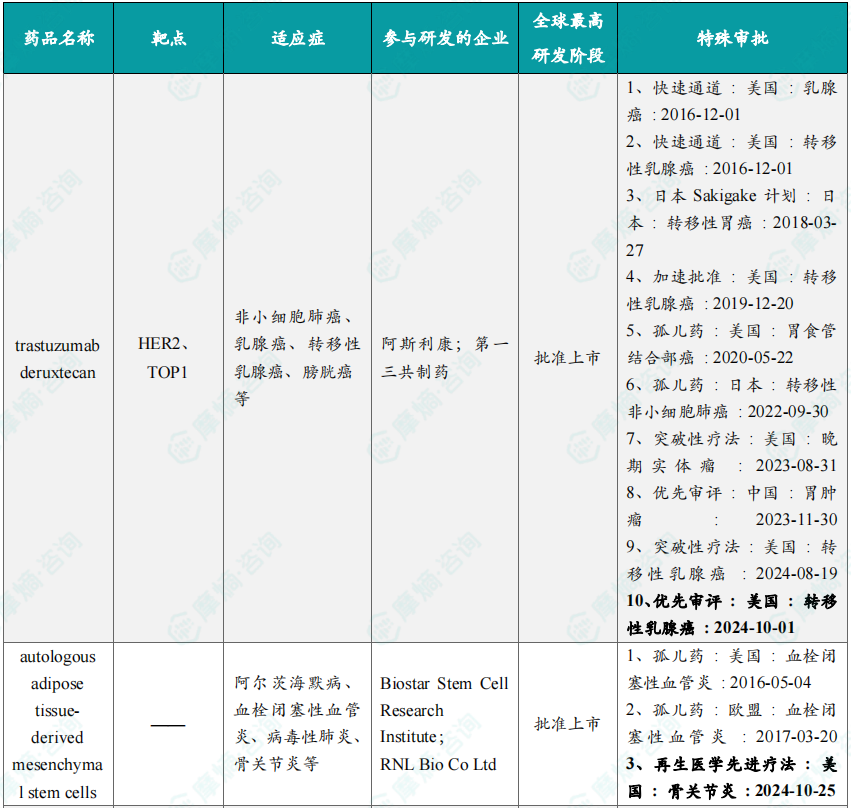
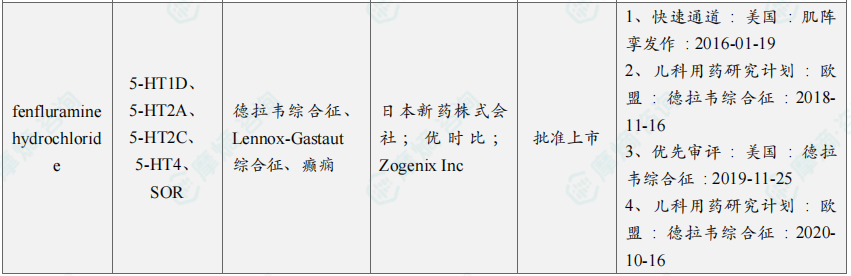
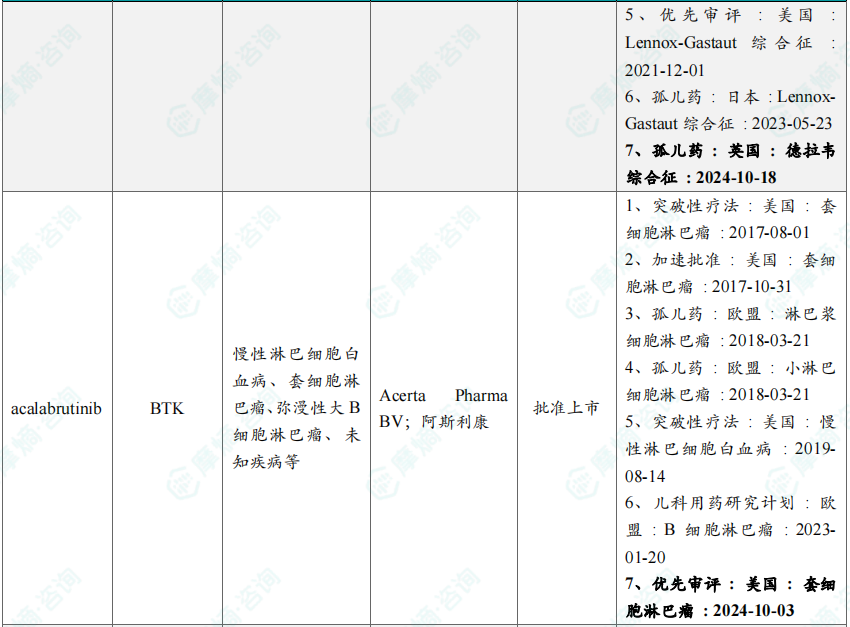

三、全球在研创新药积极/失败临床结果TOP20
在10月全球创新药研发动态中,10月11日,辉瑞(Pfizer)公布 TALAPRO-2 临床 3 期研究的预定顶线分析积极结果。分析显示,与活性对照药物相比,其多腺苷二磷酸核糖聚合酶(PARP)抑制剂 Talzenna(talazoparib)与雄激素受体途径抑制剂(ARPI)Xtandi(恩扎卢胺,enzalutamide)组合疗法可在临床和统计学上显著改善转移性去势抵抗性前列腺癌(mCRPC)患者的总生存期(OS)。
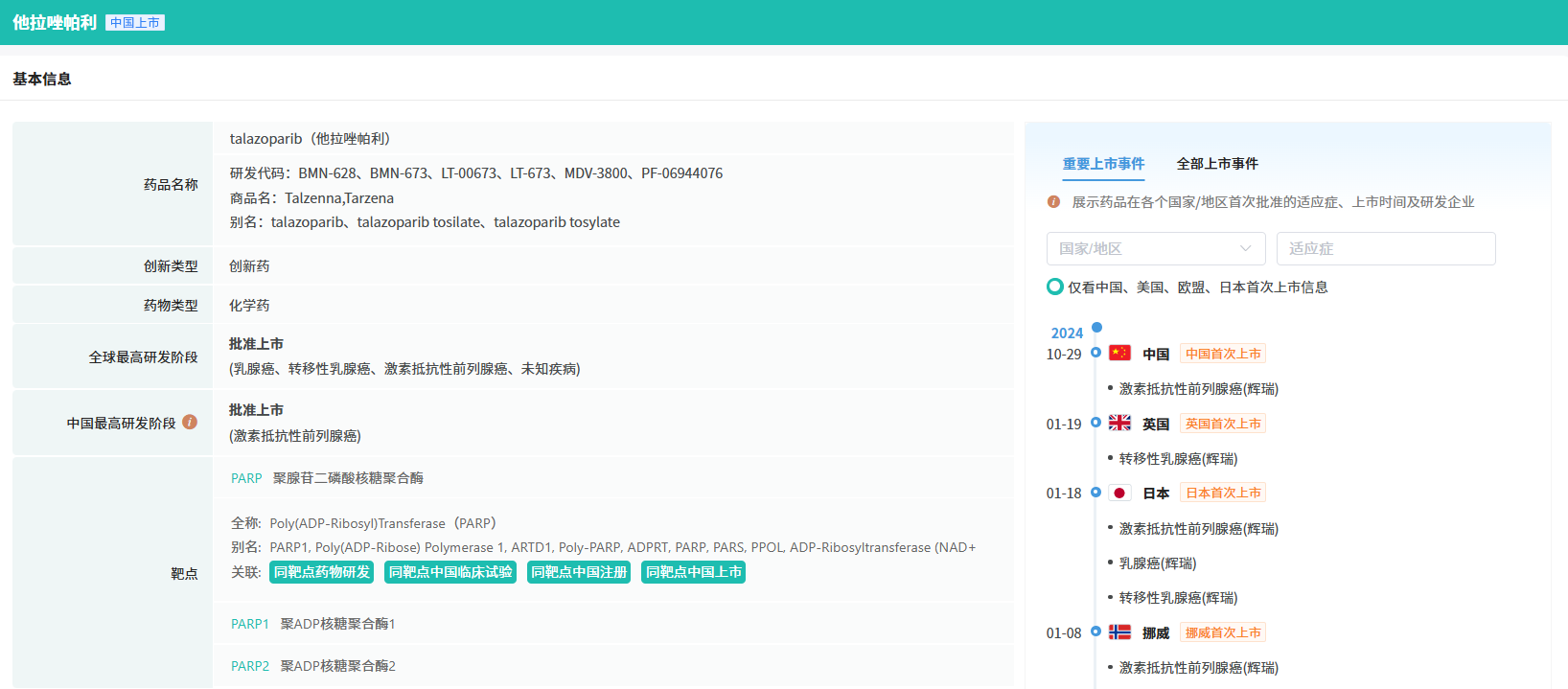
截图来源:摩熵医药全球药物研发数据库





























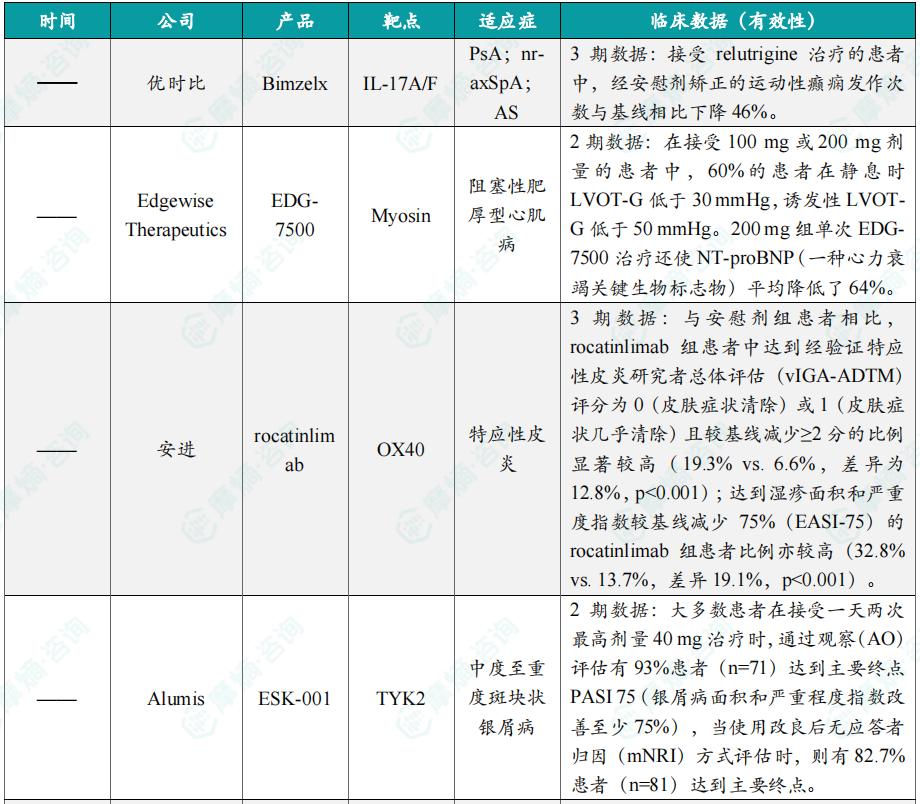
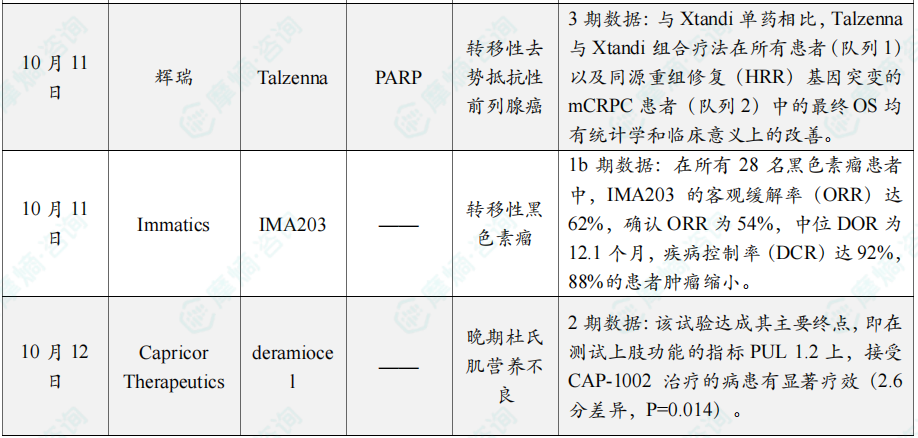
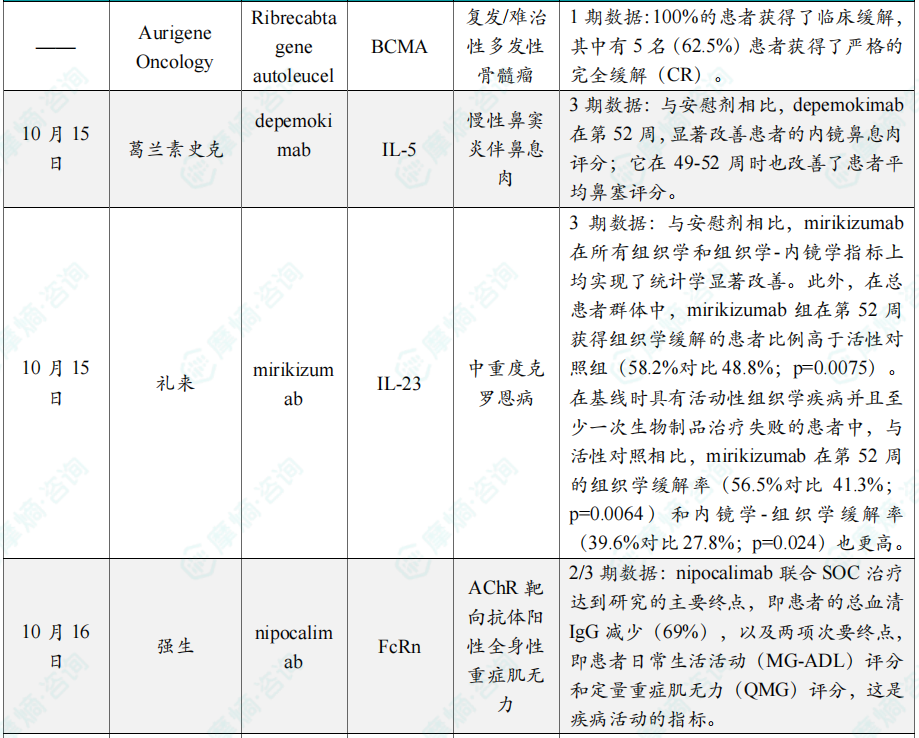












 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论