药融咨询每周定时推出《药融云医药行业观察周报》,帮助医药行业从业人员盘点国内新药注册申报情况、全球获孤儿药/突破性/快速通道资格认定品种,把握分析全球范围内的新药研发情报、临床结果最新动态以及投融资市场走向。
根据《药融云医药行业观察周报》数据统计,在2023.03.20-2023.03.26期间,共有54个创新药/改良型新药注册申请获CDE承办(按受理号统计,不含补充申请)。其中,国产药品受理号29个,进口药品受理号25个。
在这期间,共计37款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药19款,生物药17款,中药1款。另外,还有2款新药获批上市,即阿可替尼胶囊和来瑞特韦片。
部分获批临床创新药/改良型新药信息(不含补充申请)
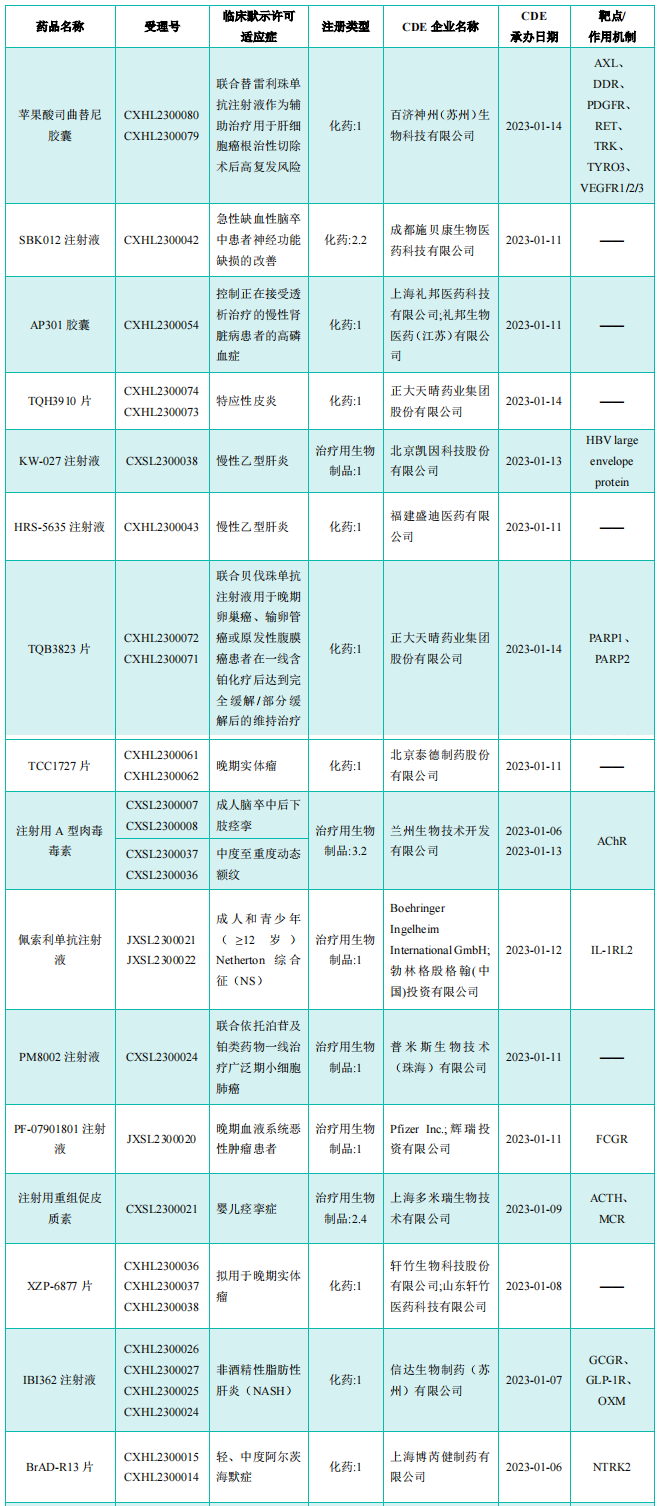
图片来源:《药融云医药行业观察周报》
其中值得注意的有:
(1)BrAD-R13片——全球首个获批临床的小分子TrkB受体激动剂
博芮健制药的BrAD-R13片获得临床试验默示许可,拟开发用于治疗轻、中度阿尔茨海默症。BrAD-R13是一款具有血脑屏障高通透性的TrkB受体激动剂,靶向作用于脑源性神经营养因子(BDNF)的TrkB受体,通过激活脑内TrkB及其下游信号通路,起到神经保护和调节突触可塑性等生理作用,从而提升脑组织的学习与记忆能力。
最新研究表明,BDNF-TrkB通路可以下调在AD发病过程中关键酶AEP的活性(δ-secretase),同时降低Aβ和Tau的产生,减少其产生的神经毒性对神经元的损害,并调节神经炎症,从而达到Disease-modifying的效果。
BrAD-R13片审评时间轴(获批临床耗时73天)

图片来源:药融云中国药品审评数据库
药融云数据库显示,BrAD-R13于2019年5月已获得美国FDA临床试验默示许可,是全球首个获批进入临床试验的小分子TrkB受体激动剂。
除阿尔茨海默病之外,博芮健制药还正在推动BrAD-R13项目用于CNS领域多种适应症的临床试验,包括帕金森症、脑损伤修复、精神分裂症、肌萎缩侧索硬化(ALS)等。
据统计,目前全球有超过5500万痴呆症患者,其中绝大多数是由阿尔茨海默病(AD)引起的,在老龄化愈加严重的情况下,到2050年预估全球将有1亿5千万患者。然而AD药物的研发道路却充满了艰难险阻,一度被认为是新药的“研发黑洞”,全球各医药巨头屡次在这个领域折戟沉沙。
全球阿尔茨海默病治疗药物研发TOP10企业
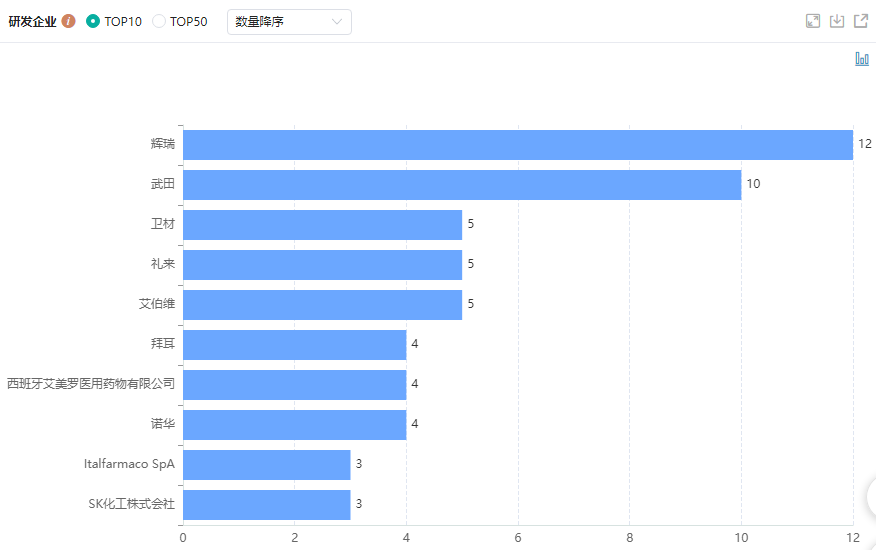
图片来源:药融云全球药物研发数据库
目前,AD药物研发的趋势是越来越倾向于创新的靶点和多通路作用的靶点。BrAD-R13在机制靶点上的创新非常切中当下AD药物研发的关键,一个是对于退行性疾病复杂病因的多靶点干预,另一个是因为患者异质性带来的临床开发不确定性,越来越多的数据表明和AD发病相关的几大风险因素(年龄、性别、ApoE4基因、高血糖、高血脂、脑创伤等)都和BrAD-R13涉及的机制相关,提示了很可能这个通路在绝大多数AD患者发病过程中起到关键性作用。
(2)FB1001注射液——治疗急性视神经病变
福贝生物的FB1001重组人源化单克隆抗体注射液获得临床试验默示许可,拟开发用于治疗急性原发性闭角型青光眼和急性非动脉炎性前部缺血性视神经病变(NAION)。
FB1001是一款具有全新靶点和作用机制的原创新药,通过特异性激活酪氨酸受体激酶B(TrkB)受体的下游信号通路,起到神经保护和修复作用。据悉,TrkB激活型抗体能够全面模拟脑源性神经营养因子(BDNF)通过TrkB介导的生物学功能,且具有较好的成药性,有望成为治疗多种神经系统重大疾病的潜在药物。
FB1001药物信息查询(部分)
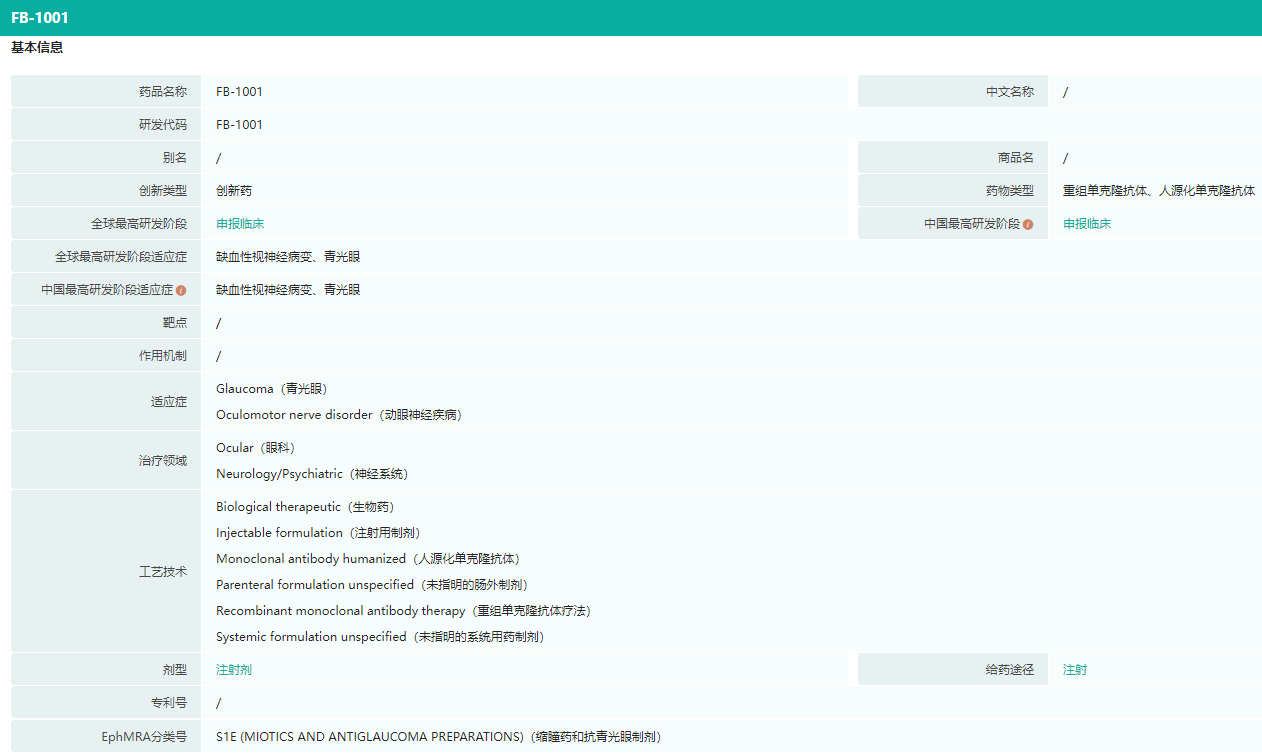
图片来源:药融云全球药物研发数据库
药融云全球药物研发数据库显示,截至目前,福贝生物有8个临床前和临床阶段项目,进度最快的是EI-1071,处于I期临床研发阶段。EI-1071是一款CSF1R抑制剂,可以高亲和力和选择性地抑制和杀伤神经系统中的小胶质细胞,有效地阻断驱动疾病发展的神经炎症反应,减缓神经损伤,帮助神经细胞修复,具备治疗脑卒中、渐冻症、阿尔茨海默症等多种神经系统疾病的潜力。
福贝生物研发管线及进度查询(部分)
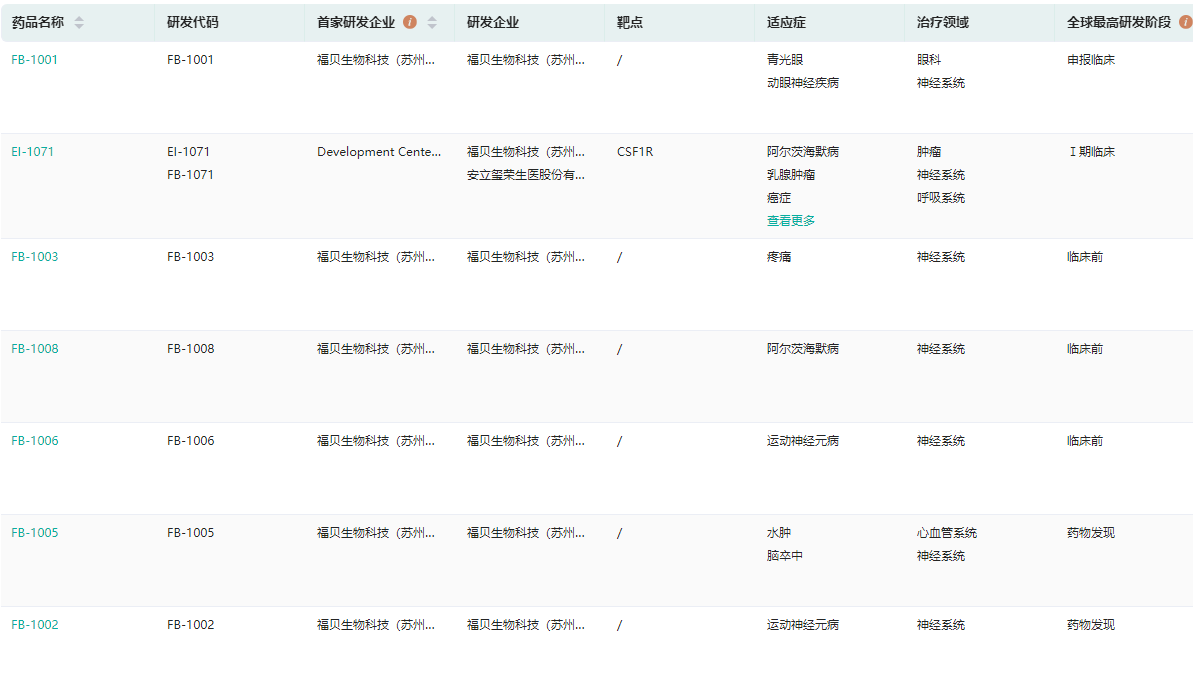
图片来源:药融云全球药物研发数据库
视神经病变泛指累及视神经的各类急慢性病变,主要导致视网膜神经节细胞及其轴突损伤和视神经退行性病变,其原发疾病包括缺血性视神经病变、青光眼、视神经炎症、外伤性、遗传性、中毒、营养缺乏等。
青光眼是全球首位致盲眼病,中国青光眼患者约占全球总量的1/4。闭角型青光眼是我国人群的常见病多发病。急性闭角型青光眼患病后视网膜神经节细胞(RGC)轴突受损迅速,如果不能立即采取降眼压和神经保护措施,则会造成RGC死亡,导致视野和视力的不可逆性损伤。
而非动脉炎性前部缺血性视神经病变(NAION)是临床上最常见的缺血性神经病变之一,也是危害中老年人视功能的重要原因之一,临床上急需能够有效保护视神经的治疗药物。期待FB1001在中国尽快完成首例病人入组,早日为患者带来切实的临床获益。
(3)迪诺仑赛注射液——治疗淋巴瘤
永泰生物的迪诺仑赛注射液获得临床试验默示许可,拟开发用于治疗CD19阳性的复发或难治性弥漫大B细胞淋巴瘤。公开资料显示,迪诺仑赛注射液在表达CD19单链抗体嵌合抗原受体基础上,同时表达阻断TGF-β信号的因子,能识别和杀伤表达CD19分子靶细胞并拮抗TGF-β信号,从而延长体内CAR-T细胞存活时间并促进CAR-T细胞浸润。
药融云数据库显示,截至目前,永泰生物旗下共有4款产品获得临床试验批件,其中,核心产品EAL(扩增活化的淋巴细胞)的Ⅱ期临床试验已完成方案设计的患者入组工作;CAR-T-19注射液和6B11-OICK注射液处于I期临床试验阶段。
EALⅡ期临床试验信息(部分)
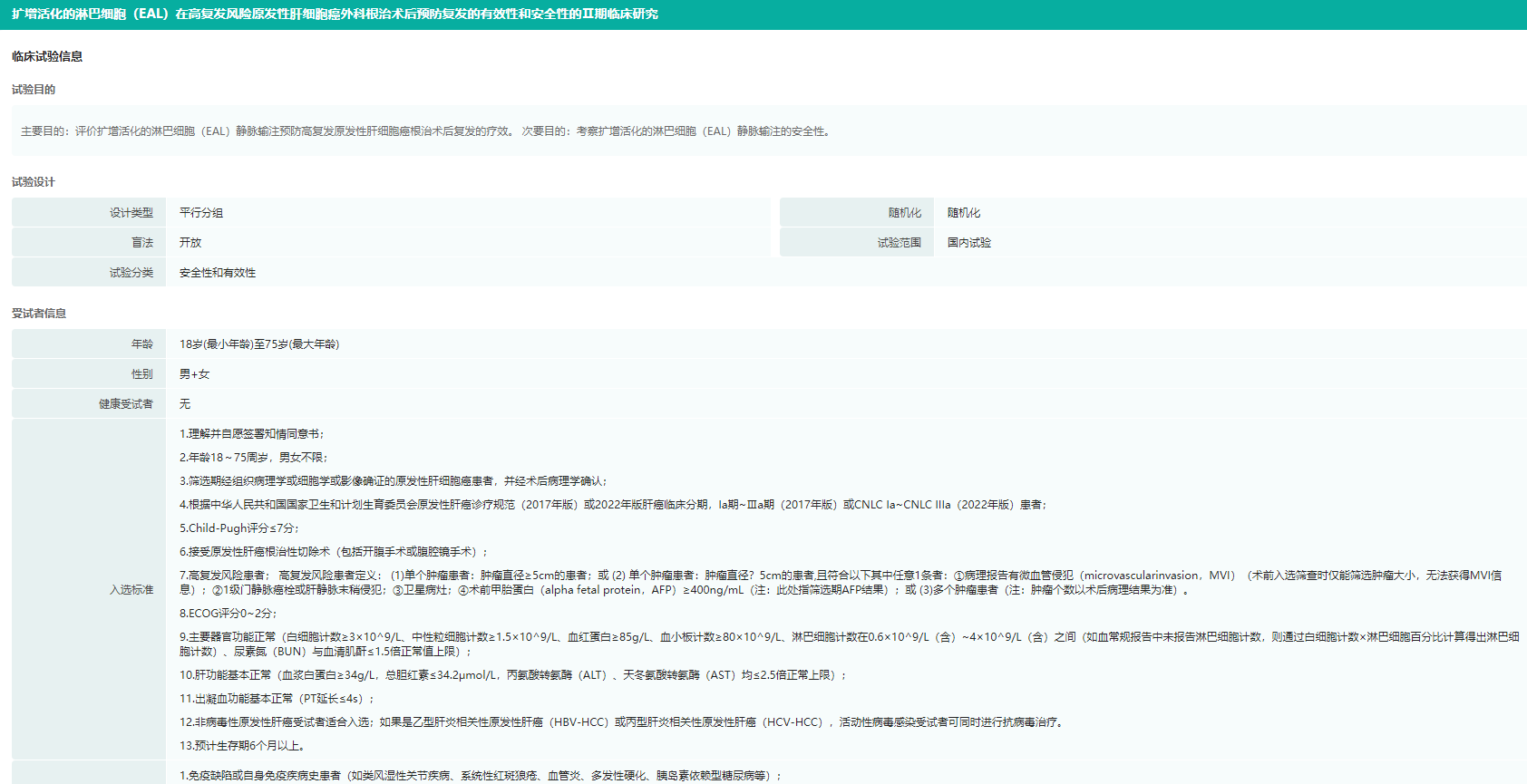
图片来源:药融云中国临床试验数据库
(4)阿可替尼胶囊——国内第4款BTK抑制剂
由阿斯利康研发的BTK抑制剂阿可替尼胶囊(acalabrutinib,商品名:康可期)在国内获批上市,用于治疗既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。阿卡替尼(Acalabrutinib)是第二代布鲁顿氏酪氨酸激酶(BTK)抑制剂,曾获得美国FDA优先审评资格、突破性疗法认定和孤儿药资格。
全球获批上市的BTK抑制剂
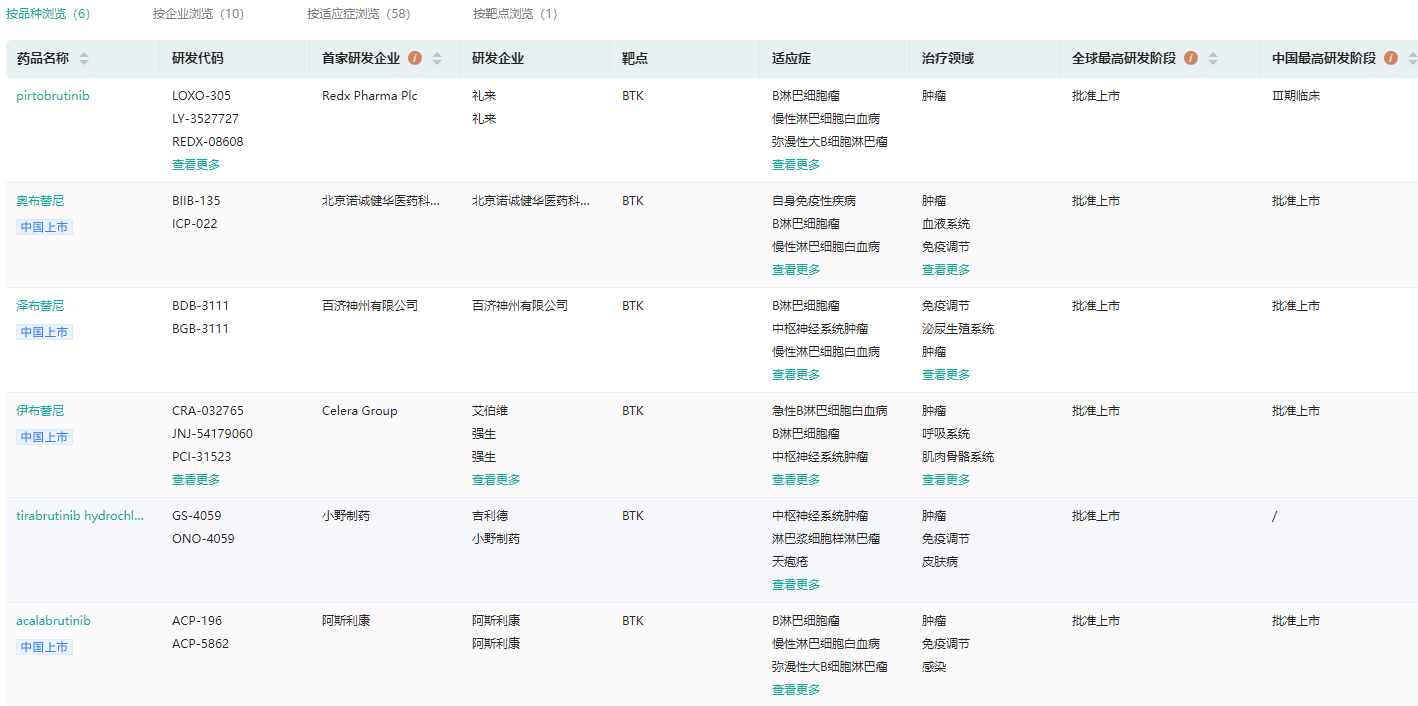
图片来源:药融云全球药物研发数据库
药融云数据库显示,截止目前,全球已有6款BTK抑制剂上市,分别是2013年获批的伊布替尼、2017年获批的阿卡替尼、2019年上市的泽布替尼、2020年上市的替拉鲁替尼和奥布替尼,2023年上市的pirtobrutinib。其中,强生的伊布替尼、百济神州的泽布替尼、诺诚健华的奥布替尼、阿斯利康的阿卡替尼已在中国上市。
药融云数据库显示,2021年国内BTK抑制剂总销售额约180亿元,其中伊布替尼占据了超一半市场份额;其次为泽布替尼,市场份额约36%;奥布替尼市场份额约13%;阿斯利康的阿卡替尼在中国上市,将打破国内“三足鼎立”的市场竞争格局。
(5)来瑞特韦片——抗新冠病毒3CL蛋白酶
来瑞特韦片通过作用于新型冠状病毒(SARS-Cov-2)的3CL蛋白酶,抑制病毒多聚前体蛋白的切割,进而阻断病毒复制,达到抗新冠病毒的作用。来瑞特韦片在野生株、阿尔法、贝塔、德尔塔、奥密克戎(包括BA.5、BF.7)等多种新冠病毒感染的细胞模型中,可以有效抑制新冠病毒复制,展现了广谱抗新冠病毒的能力。
药融咨询是药融云旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托药融圈丰富的外部专家资源及药融云全面的医药全产业链数据库,为客户提供专业咨询服务与定制化解决方案。
想要获取《药融云医药行业观察周报》完整内容,欢迎关注“药融云(yrydata)”公众号,后台回复“报告”关键词进行领取。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论