
1月29日晚,CDE发布通知,药品审评中心对《eCTD实施指南V1.0》及《eCTD验证标准V1.0》进行了修订,并形成征求意见稿。

为更好地落实《国家药监局关于实施药品注册申请电子申报的公告》(2022年第110号)要求,统一eCTD申报资料和电子申报资料关于文件大小的有关要求,药品审评中心对《eCTD实施指南V1.0》(以下简称《实施指南》)及《eCTD验证标准V1.0》(以下简称《验证标准》)进行了修订,形成征求意见稿。
修订内容主要包括:
一、删除《实施指南》2.8章节关于纸质资料的递交要求;
二、删除《实施指南》4.1.2章节和附件说明函中关于纸质资料的相关内容,包括“关于纸质资料与eCTD申报资料内容一致的承诺”和“关于按规定时限一次性提交全部纸质申报资料的承诺;
三、修改《实施指南》7.6章节关于文件大小的要求,将单个PDF文件应控制在500MB以内修改为200MB以内;
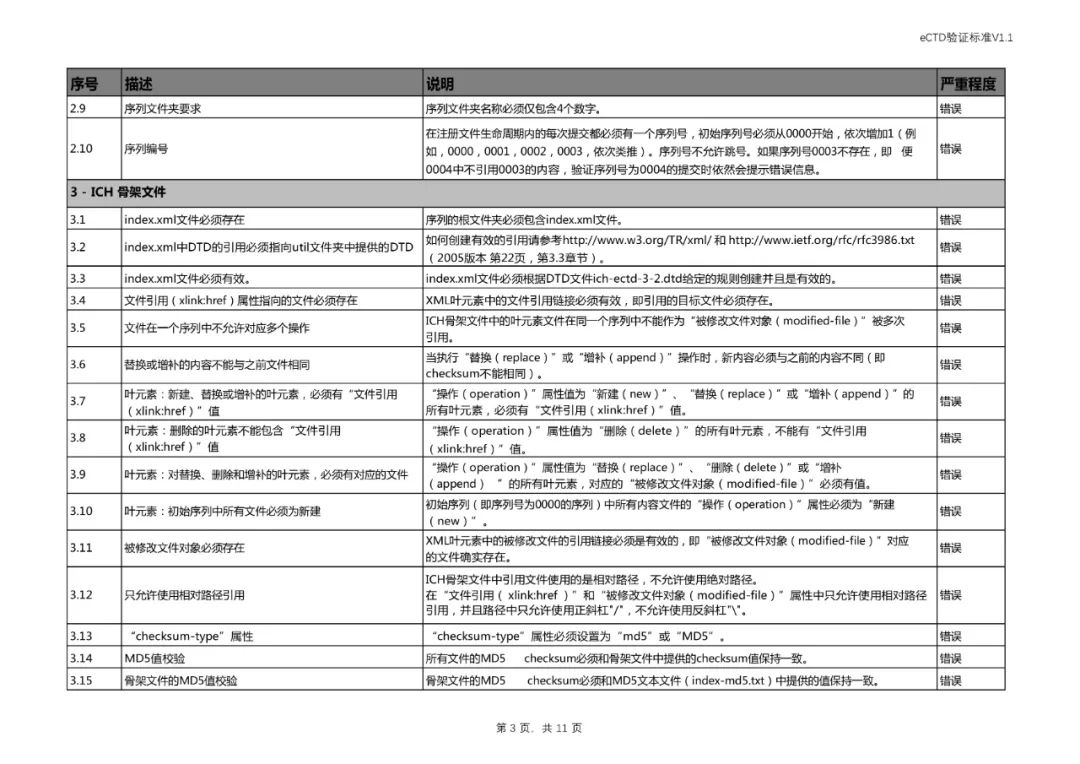
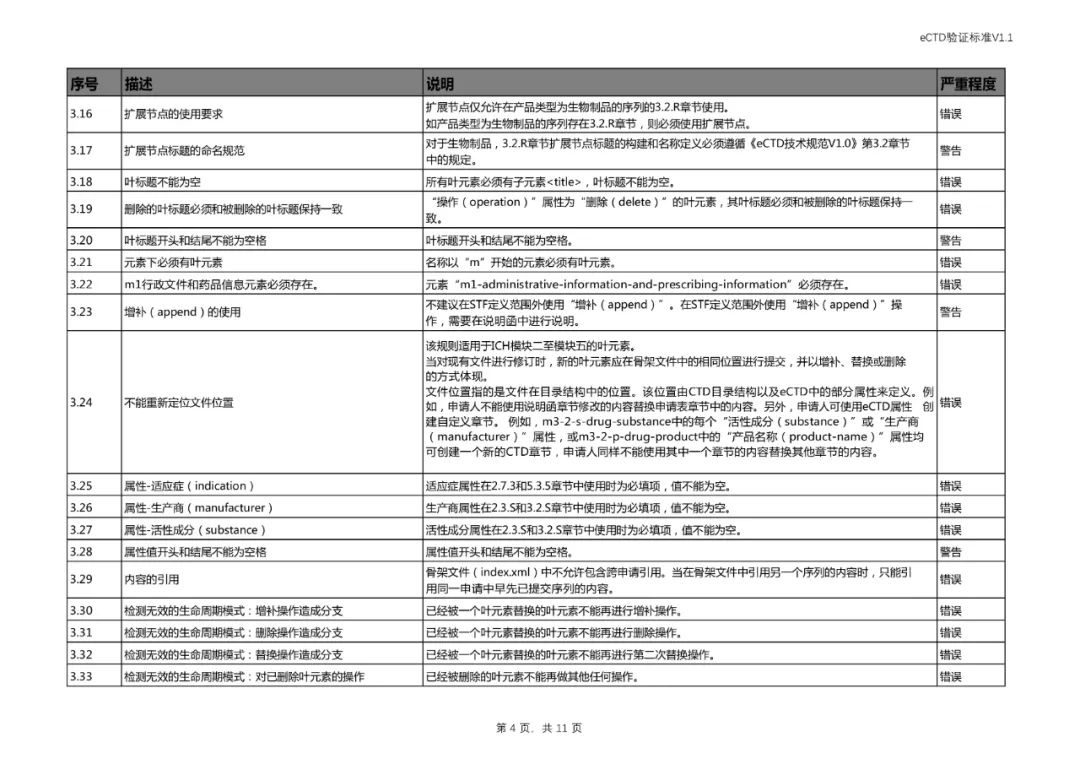
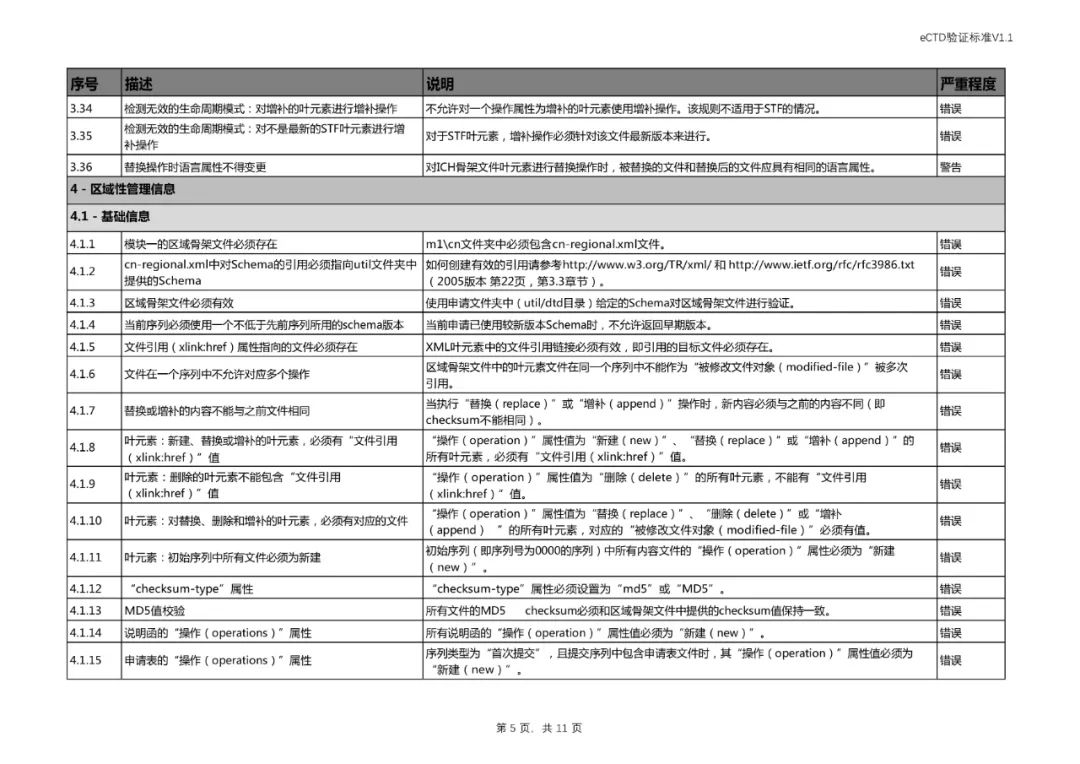
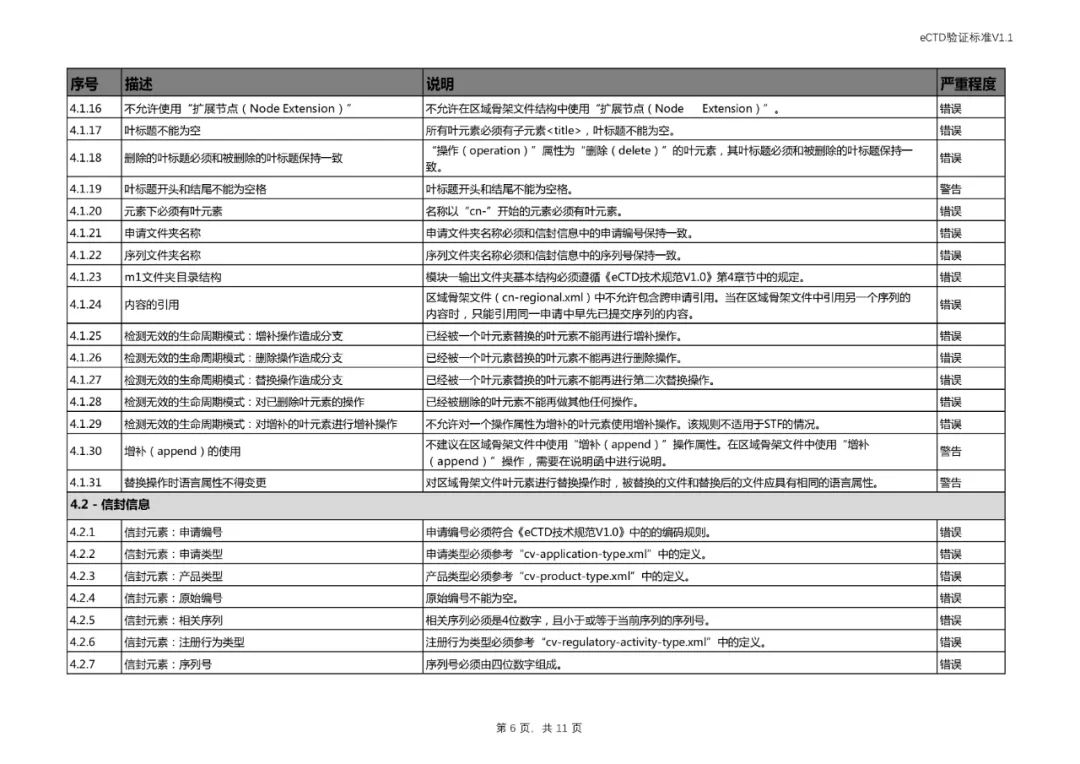
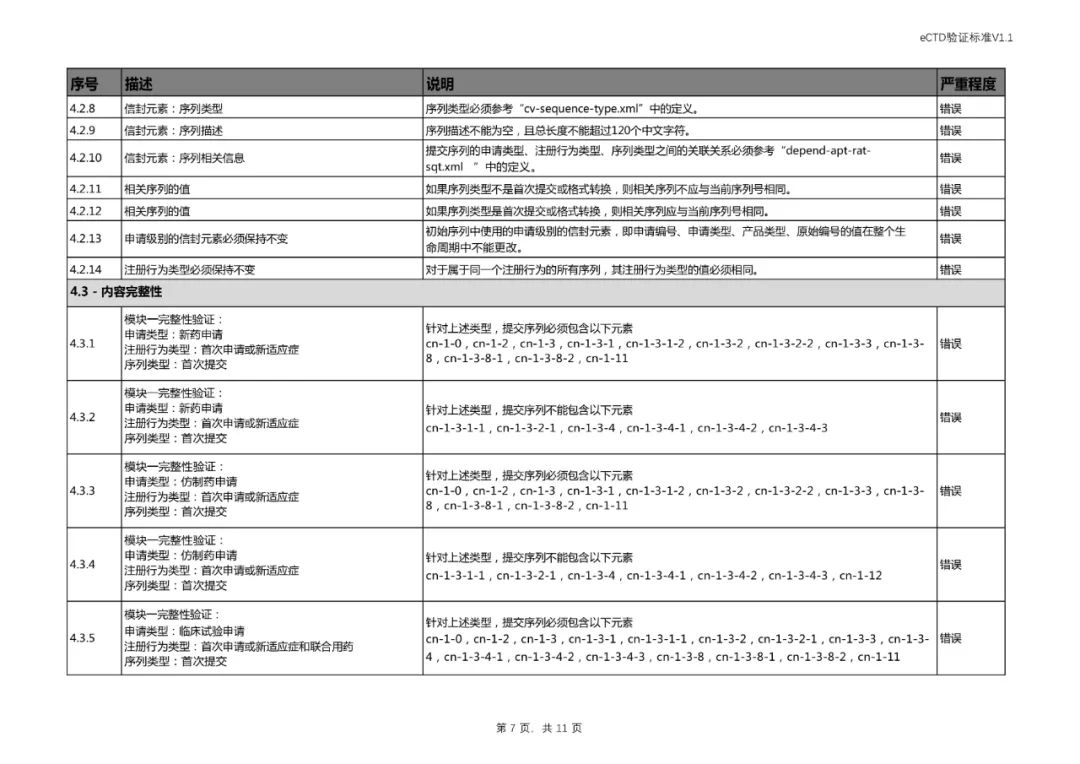
四、对《验证标准》相对应部分进行了修订。
现向社会公开征求意见,征求意见时限为自发布之日起1个月。请将反馈意见发送到以下联系人的邮箱,感谢您的参与和大力支持。
联系人:李海玲
联系方式:lihl@cde.org.cn
国家药品监督管理局药品审评中心
2023年1月29日
















































<END>





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论