今天,CFDI更新了2个药品注册申请药学研制和生产现场核查任务信息公告,其中2021年第15号8个注册申请,第16号8个注册申请!

我中心已接收药品审评中心发起《药品注册管理办法》(市场监管总局令第27号)实施前受理的8个药品注册申请的药学研制和生产现场检查任务,相关任务信息现予以公告(详见附件)。
根据原《药品注册管理办法》(国家食品药品监督管理局局令第28号),已接收到药品审评中心相关申请生产现场检查通知文件的注册申请人,且自认为具备接受现场核查条件的,需在规定时间内登陆我中心网站(www.cfdi.org.cn),通过“药品注册申请人之窗”提交药品注册申请生产现场检查的申请。我中心将根据药品注册申请人可以接受现场检查的时间等安排,组织现场检查工作,其中优先审评品种予以优先安排。
请相关药品注册申请人予以关注,逾期不提交,我中心将按照有关规定终结相关检查任务,并回复药品审评中心。
感谢支持和配合。如有不解事宜,请与我中心联系。
联 系 人:刘瑾欣 高胜男
联系电话:010-68441674 010-68441659
传 真:010-68441300
联系地址:北京市西城区文兴街1号院3号楼北矿金融大厦6层
邮 编:100044
附 件:图片药品注册申请药学研制和生产现场检查任务(2021年第15号).pdf
国家药品监督管理局食品药品审核查验中心
2021年7月7日


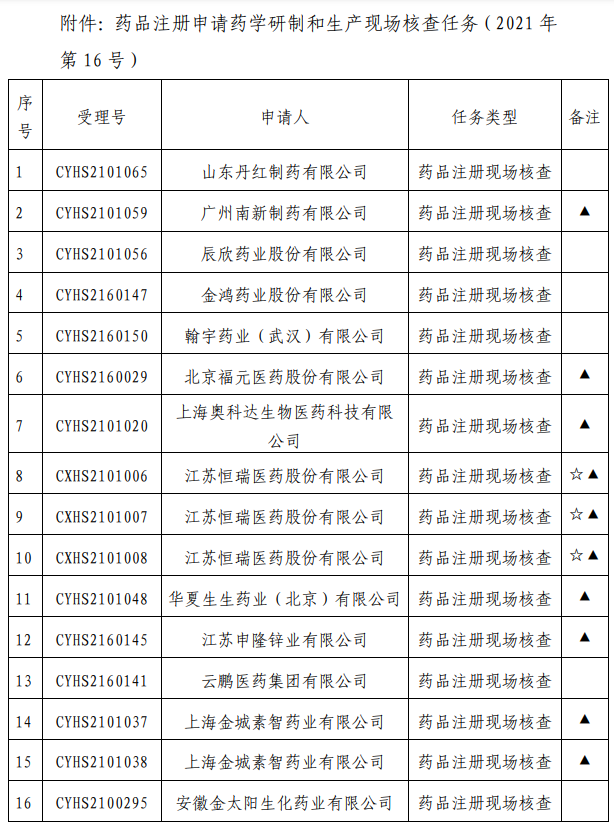
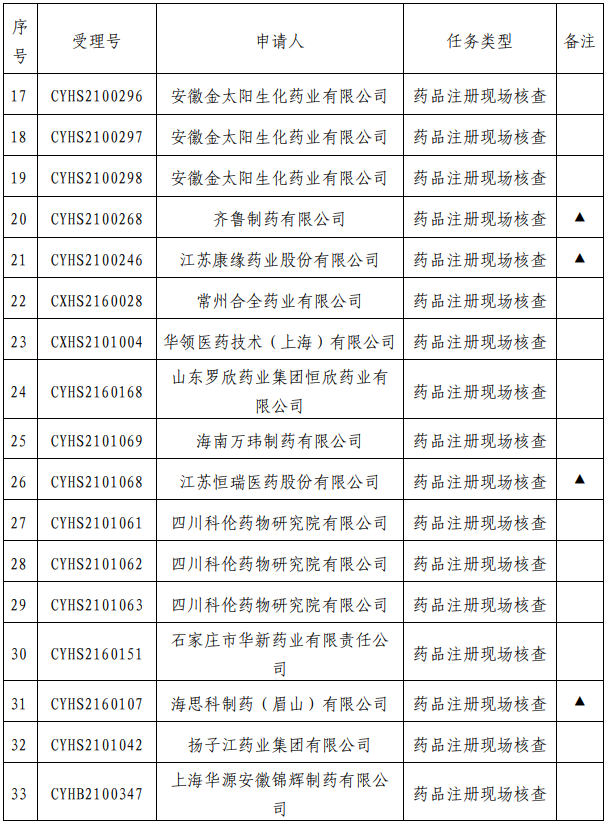
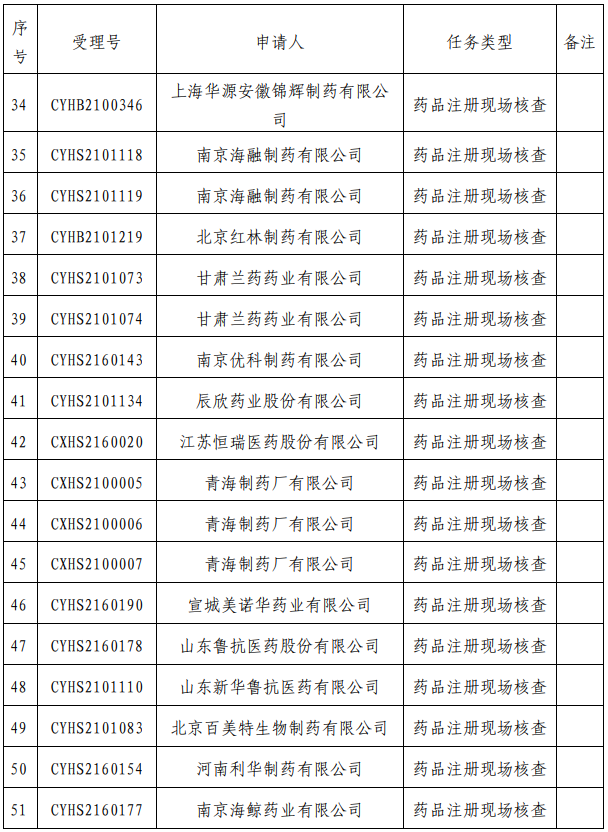
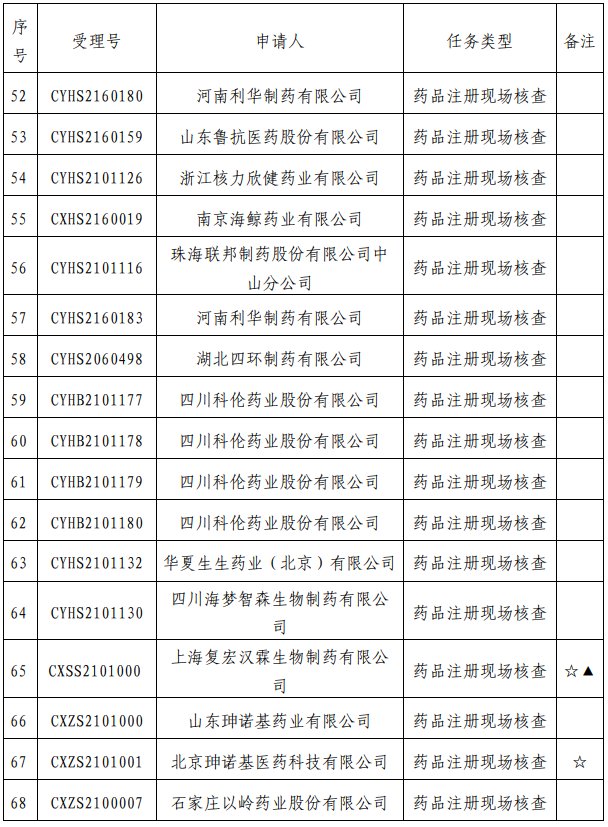
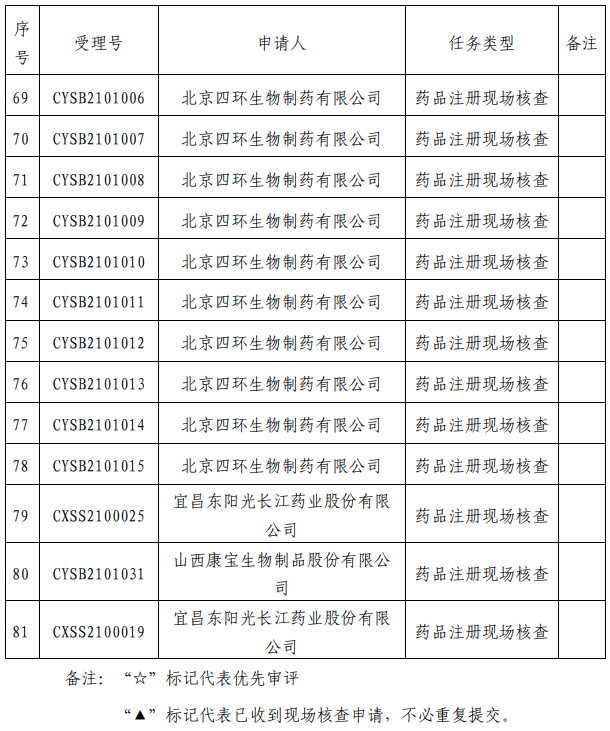
我中心已接收药品审评中心根据《药品注册管理办法》(市场监管总局令第27号)第48条规定启动的第十四批81个药品注册申请的药学研制和生产现场核查任务,相关任务信息现予以公告(详见附件)。
根据《药品注册管理办法》,请已收到药审中心相关药学研制、生产现场核查告知材料的注册申请人,尽快登陆我中心网站(www.cfdi.org.cn),通过“药品注册申请人之窗”确认药品注册核查事宜。我中心将根据药品注册申请人可以接受现场核查的时间等综合信息,组织安排现场核查工作,其中优先审评品种予以优先安排。
请相关药品注册申请人予以关注,按照相关程序规定逾期提交者,我中心将顺延相关核查任务组织和完成时间,并通知药品审评中心。
感谢支持和配合。如有不解事宜,请与我中心联系。
联 系 人:刘瑾欣 高胜男
联系电话:010-68441674 010-68441659
传 真:010-68441300
联系地址:北京市西城区文兴街1号院3号楼北矿金融大厦6层
邮 编:100044
附 件: 药品注册申请药学研制和生产现场核查任务(2021年第16号).pdf
药品注册申请药学研制和生产现场核查任务(2021年第16号).pdf
国家药品监督管理局食品药品审核查验中心
2021年7月7日






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论