
生物医药全产业链数据服务平台
掌上数据


打开微信扫一扫
产品矩阵

摩熵数科产品矩阵
查看详情
{{ item.category }}
{{ product.info.desc }}
-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用
"欧盟"相关的结果
-
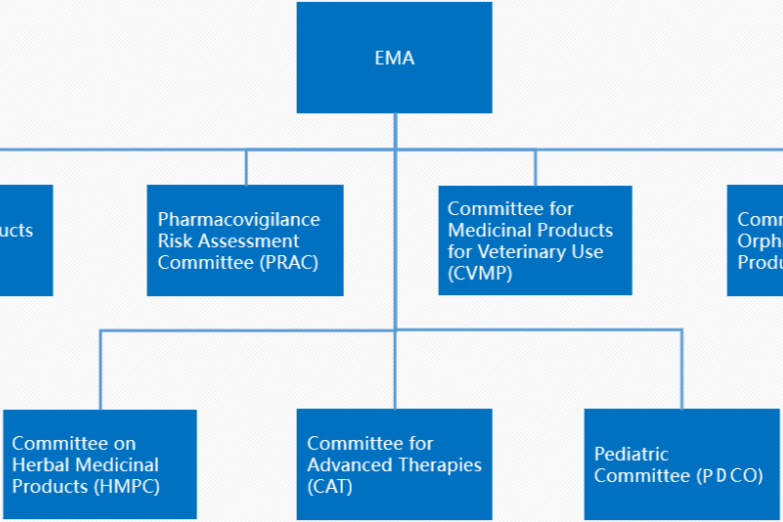
欧盟药品集中、分权、互认、成员国等审批程序【温故知新】
目前,欧盟药品注册审批程序有集中审批程序(CP)、互认可审批程序(MRP)、分权审批程序(DCP)和成员国审批程序(INP)这几种途径,欧盟集中审批药品(Centralized Procedure, CP)是一种由欧洲药品管理局(EMA)负责审评、欧盟委员会(EC)负责批准的药品上市许可程序。根据法规(EC)726/2004,集中审批程序允许通过一次上市许可申请(MAA)...... -

欧盟COS/CEP证书认证信息数据库在线查询
药融云-欧盟CEP认证数据库就将EDQM官网发布的数据进行收集和整理,是国内专业的欧盟CEP认证信息查询系统。 检索路径:药融云-->企业版-->原料药-->欧盟CEP认证-->数据检索 药融云官网:https://www.pharnexcloud.com/欧盟308802年前 -

或有致癌风险,GLP-1类减肥药面临欧盟安全性审查!
6月22日,据fiercepharma报道,欧洲药品管理局(EMA)已将GLP-1药物标记为甲状腺癌的潜在风险,包括诺和诺德的Ozempic和Wegovy,以及礼来的Mounjaro。监管机构要求公司在7月26日之前提交更多信息。欧洲药品管理局已经加强了对GLP-1治疗的审查,提出了一个关于糖尿病和肥胖药物可能导致癌症的潜在风险的安全信号。 -

全球最贵药!350万美元的AAV基因疗法,欧盟获批上市!
2月20日,CSL Behring(ASX: CSL)宣布,欧盟委员会已批准AAV基因疗法Hemgenix 有条件上市(CMA),这是欧盟委员会批准的首款治疗血友病B成人患者的基因疗法。临床前和临床数据表明,基于AAV5的基因疗法对大部分具有AAV载体抗体的B型血友病患者临床有效。 -

加速临床试验研究,欧盟2022-2026年工作计划发布
8月30日,欧洲委员会(EC)、药品机构负责人(HMA)和欧洲药品管理局(EMA)发布欧盟加速临床试验研究(ACT-EU)2022-2026年工作计划。欧盟209303年前 -

欧盟上市药品查询!30个国家查询网站一文打尽
众所众知,欧盟是由多个国家组成,查询全面的上市药品信息,也相对麻烦。除了欧洲药品管理局EMA,以外一些特定国家药品上市信息需要单独查询,就让我们盘点下吧。 -

辉瑞/默克Bavencio一线维持治疗转移性尿路上皮癌获欧盟批准
1月25日,辉瑞与默克联合宣布,欧盟委员会已批准抗PD-L1疗法Bavencio(avelumab),用于一线维持治疗接受含铂化疗后病情没有进展的局部晚期或转移性尿路上皮癌(UC)成人患者。 -

罗氏Xofluza治疗流感获欧盟批准
1月11日,罗氏宣布,欧盟委员会(EC)已批准Xofluza®(baloxavir marboxil)用于治疗12岁及以上的简单流感患者。 -

罗氏Phesgo治疗HER2阳性乳腺癌在欧盟获批
12月23日,罗氏和Halozyme Therapeutics公司宣布,欧盟委员会已批准由罗氏Perjeta®(pertuzumab,帕妥珠单抗)和Herceptin®(trastuzumab,曲妥珠单抗)与透明质酸酶结合的固定剂量组合药物Phesgo®皮下注射(SC)制剂用于治疗早期和转移性HER2阳性乳腺癌。 -

子宫肌瘤新药!同类最佳GnRH受体拮抗剂linzagolix欧盟申请上市
近日,ObsEva SA宣布,已向欧洲药品管理局(EMA)提交了Yselty(linzagolix 100mg和200mg)的营销授权申请(MAA),该药用于治疗与子宫肌瘤相关的月经过多(Heavy Menstrual Bleeding,HMB)。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息