
8月30日,欧洲委员会(EC)、药品机构负责人(HMA)和欧洲药品管理局(EMA)发布欧盟加速临床试验研究(ACT-EU)2022-2026年工作计划。工作计划指出欧洲临床试验的监管格局复杂,不同的专家组在不同的领域工作,从发布指南,提供科学建议,到批准临床试验,为新药或治疗策略提供证据,缺乏一个明确的共同框架。

工作计划以2025年欧洲药物监管网络(EMRN)战略和欧盟委员会欧洲药物战略的建议为基础,强调进一步促进临床试验创新、利益相关者参与和监管重点领域。
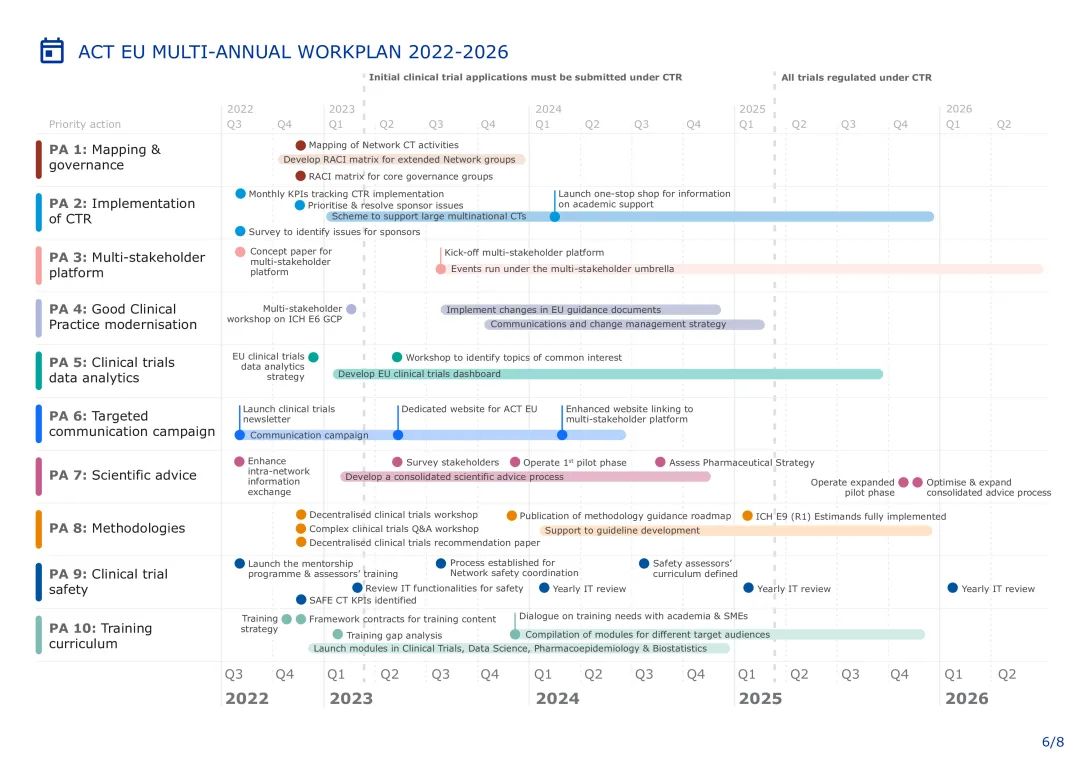
同时,工作计划列出了交付成果和时间表,包括:
大型跨国公司临床试验:建立专门针对学术赞助商的支持流程,以使欧盟成为更具吸引力的临床研究地区。
CTR的实施:特别关注临床试验信息系统(CTIS)和欧盟临床试验条例(CTR)培训活动,并解决临床试验发起人遇到的任何问题。
多方利益相关者平台:将于2023年建立,通过包括患者、医疗专业人员和学术界在内的所有利益相关者之间的定期对话,促进临床试验环境的演变,以找到实现和推动变革的实际解决方案。
现代化的良好临床实践:临床研究计划将不仅支持技术和临床试验设计方面修订后的欧盟指南的采用,而且支持其在临床中实施。
去中心化临床试验:该计划将在2022年底前发布去中心化临床试验,并发布方法路线图,以确定临床试验方法的关键进展并确定其优先顺序。







<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论