
新药获批“续写”诺奖
2009年诺贝尔生理学或医学奖授予了三位科学家Elizabeth H. Blackburn、Carol W. Greider和Jack Szostak博士,以表彰他们“发现端粒和端粒酶是如何保护染色体的”。

截图自The Nobel Prize
端粒是位于染色体末端的脱氧核糖核酸(DNA)重复序列,其研究可以追溯到20世纪70年代,它们作为“保护帽”,以保持染色体的稳定性和完整性,由于细胞每分裂一次,端粒就会缩短一次,当端粒缩短到极短长度时,细胞要么死于细胞凋亡,要么停止分裂和衰老。因此大多数细胞分裂次数有限,且分裂次数受端粒长度的调节,端粒也被科学家称作“生命时钟”。
端粒酶在1984年被发现,这是一种天然产生的酶,能够维持端粒长度,防止它们在细胞(例如干细胞)分裂时缩短,以维持正常的人体健康。端粒酶至少由两个部分组成:一个核糖核酸(RNA)模板,可与端粒结合;以及一个具有逆转录酶活性的催化亚基,可在染色体末端添加一个特定的DNA序列。
2024年6月6日,美国生物制药公司Geron Corporation(杰龙)宣布其开发的First-in-Class端粒酶抑制剂RYTELO(Imetelstat)获得FDA批准用于治疗低至中度-1风险骨髓增生异常综合征(MDS)成年患者的输血依赖性(TD)贫血,这些患者在8周内需要输入四个或更多的红细胞单位,且对红细胞生成刺激剂(ESA)无反应或已经耐药或不适合使用ESA。
据了解,RYTELO(Imetelstat)是全球首款获批上市的端粒酶抑制剂,该药物曾被Evaluate Pharma评为2024年有望上市的10款全球重磅药物之一,另据药融咨询报道,Imetelstat年销售额峰值或可达20亿美元。
2023年9月,Geron Corporation在欧洲为RYTELO(Imetelstat)递交了一份上市许可申请,适应症与美国相同,预计监管审查将在2025年初完成,该公司计划在2025年最终确定该药在欧洲的商业化战略,可能包括自主商业化或潜在的伙伴关系。

截图自药融云数据库
20年曲折开发历程
Geron Corporation由干细胞、细胞衰老和端粒酶研究的先驱Michael West和当时Kleiner Perkins Caufield& Byers的合伙人,知名风险投资家Alex Barkas在1990年创立。1996年,Geron成为了一家上市公司(Nasdaq: GERN),前文提到的三位诺奖科学家,以及美国知名生物学家Leonard Hayflick(他提出了“海夫利克极限”)均是该公司当时的科学顾问。2003年,Geron公司开发了与端粒酶的RNA模板结合并竞争性抑制端粒酶活性的寡核苷酸,2005年Geron通过使用脂质修饰增强了这一端粒酶抑制剂的效力,Imetelstat由此诞生,因此该药物本质是一种脂质偶联的13-mer寡核苷酸。20年新药创制,30余年创业新药公司终于成就一款新药。

不过Imetelstat的开发历经曲折,该药物最早曾针对非小细胞肺癌、胶质瘤等开展过临床试验,但均以失败告终,Geron公司便将重点放在血液系统肿瘤。2014年,该公司与强生旗下杨森制药就Imetelstat达成了全球战略合作,共同推进开发和商业化工作,该交易总额高达9.35亿美金。合作期间,Imetelstat针对骨髓增生异常综合征(MDS)和骨髓纤维化(MF)分别开展了2期研究,但是两项研究的结果并未达到强生的预期,双方遂于2018年终止了合作。
2019年,Geron公司推进了Imetelstat治疗低风险骨髓增生异常综合征(MDS)的IMerge 3期临床试验。MDS是最常见的髓系恶性肿瘤,在临床上常以严重贫血、低红细胞计数、血红蛋白低为特征,多达30%的MDS病例会转化为AML(急性髓系白血病)。据统计,美国约有6万人患有该病,每年约有1.6万例MDS新发病例。其中,慢性贫血是低风险MDS患者的主要临床问题,虽然红细胞生成刺激剂(ESA)可以改善约50%的患者的贫血,但其效果是短暂的,中位反应持续时间约为两年。
2023年1月,Geron报告了IMerge关键3期临床试验的积极顶线结果,该试验评估了Imetelstat在TD LR-MDS(输血依赖型低风险骨髓增生异常综合征)患者中的疗效,研究结果于2023年12月刊登于《柳叶刀》。此次美国FDA批准RYTELO(Imetelstat)以及该药在欧洲的递交都是基于这项研究。

截图自The Lancet
这项关键3期临床试验达到了至少8周不依赖红细胞输血(RBC-TI)的主要终点和至少24周不依赖红细胞输血(RBC-TI)的关键次要终点,证明了Imetelstat与安慰剂相比具有高度统计学意义和临床意义的益处,具体而言,Imetelstat组患者8周RBC-TI为39.8%,而安慰剂组为15%;Imetelstat组患者24周RBC-TI为28%,安慰剂组为3.3%。

此外,该试验在关键MDS患者亚型中观察到了具有统计学意义和临床意义的疗效结果,包括环状铁粒幼红细胞阳性(RS阳性)和环状铁粒幼红细胞阴性(RS阴性)的患者、基线输血负担高(4-6红细胞单位/8周)和非常高的(>6红细胞单位/8周)的患者,以及根据国际预后评分系统(IPSS分类)为低或中-1风险的患者。
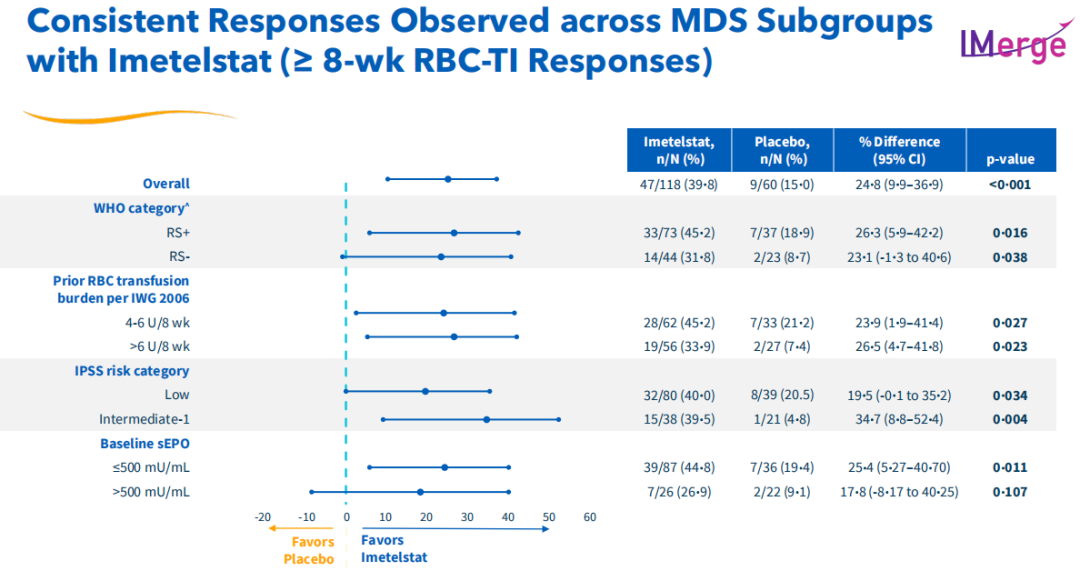
安全性结果与先前的Imetelstat临床试验一致,最常见的3/4级不良反应是中性粒细胞减少症(72%)和血小板减少症(65%),其中位持续时间不到2周,超过80%的患者在4周内控制为2级以下。
2024年3月14日,美国FDA就Imetelstat根据IMerge 3期临床试验的结果召开肿瘤药物咨询委员会(ODAC)会议,最终委员会以12:2的投票结果赞成Imetelstat的临床益处大于风险,消息公布次日,Geron公司股价暴涨92%。6月6日,RYTELO(Imetelstat)成功获批,比此前设定的PDUFA日期提早了10天。
2024年7月26日,Geron公司宣布美国国家综合癌症网络(NCCN)更新了骨髓增生异常综合征(MDS)的肿瘤学临床实践指南(NCCN指南),推荐RYTELO(Imetelstat)作为低风险MDS患者继发性贫血的1类和2A类治疗方案。

探索多种血液瘤、联合疗法
除了低风险骨髓增生异常综合征(MDS),Geron公司正在开发Imetelstat用于治疗其他髓系血液系统恶性肿瘤。
骨髓纤维化(MF)是一种骨髓增生性肿瘤,据统计,美国约有1.3万名MF患者,每年报告约3000名新发病例,约有70%的患者被归为中-2风险或高风险,对于JAK抑制剂治疗无效或耐药的患者,尚无药物获批用于后续治疗,因此存在显著的未满足医疗需求。
该公司开展的IMpactMF3期临床试验正在评估Imetelstat治疗中-2风险或高风险骨髓纤维化(MF)患者,这些患者接受JAK抑制剂治疗后复发或对JAK抑制剂耐药,称为复发/难治性MF患者,该研究以总生存期(OS)作为主要终点。2024年8月,该试验完成约70%患者入组,基于目前对试验中入组和事件(死亡率)的计划假设,该公司预计IMpactMF研究的OS中期分析可能在2026年初进行,最终分析可能在2027年初进行。

Geron公司还在开展一项名为IMproveMF的1期临床试验,旨在研究Imetelstat与芦可替尼作为联合疗法,用于一线治疗中-1风险、中-2风险或高风险的骨髓纤维化(MF),目前该研究正在招募患者。

由研究者发起的IMpress2期临床试验,旨在研究Imetelstat用于治疗高风险骨髓增生异常综合征(MDS),和复发/难治性急性髓系白血病(AML),这些患者先前接受过低甲基化剂(HMA)治疗,研究已在2023年6月完成首例患者给药。
另外,Geron公司计划在IMpress研究结果公布之前支持一项由研究者发起的,名为TELOMERE的1/2期试验,旨在研究Imetelstat与维奈克拉或阿扎胞苷作为联合疗法,治疗复发/难治性(AML)患者。
对于临床前研究,Geron公司正与MD安德森癌症中心合作,计划开展临床前研究,以评估Imetelstat在淋巴细胞恶性肿瘤中的潜在治疗效果。除此之外,该公司也启动了一个药物发现项目,以确定潜在下一代口服端粒酶抑制剂的先导化合物。

财务状况
在RYTELO(Imetelstat)上市之前,Geron公司主要通过出售股权证券、有价证券的利息收入以及根据合作和许可获得的付款来为业务提供资金,所有收入基本上来自于合作协议、里程碑付款、特许权使用费和其他许可收入。截至2024年6月30日,该公司累计赤字约为17亿美元。
2023全年,Geron公司总收入23.7万美元,主要来自于先前该公司剥离的干细胞资产中基于细胞的研究产品销售的特许权使用费;全年总运营费用为1.941亿美元,其中研发费用为1.25亿美元,主要是由于临床试验成本增加,一般和管理费用为6910万美元。

2024年上半年,Geron公司总收入为118.6万美元,其中RYTELO(Imetelstat)产品收入为78万美元(自2024年6月27日起,处方者可从专业分销商处订购该产品,截至7月31日,公司估计约有160名患者接受了RYTELO治疗);上半年总运营费用为1.267亿美元,其中销售成本为1.7万美元,研发费用为6020万美元,一般和管理费用为6650万美元。
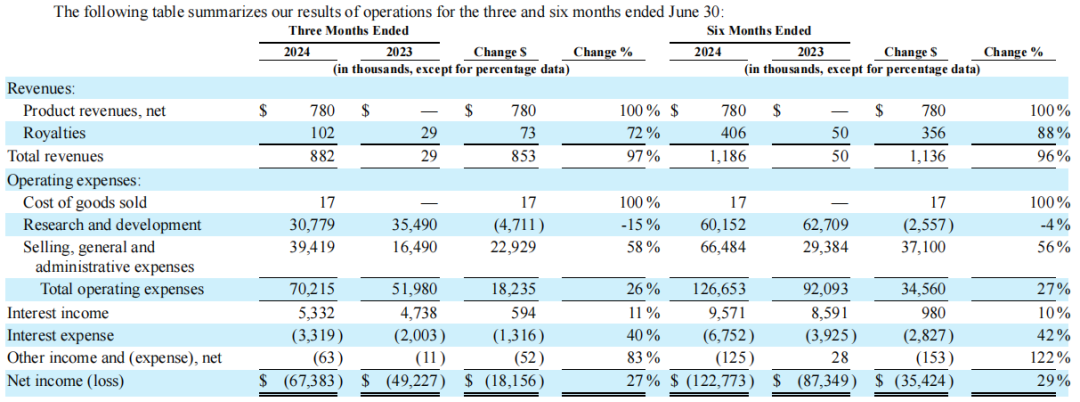
截至2024年6月30日,Geron公司拥有现金、现金等价物、限制性现金和有价证券约4.304亿美元,加上RYTELO(Imetelstat)在美国的预期销售收入,将足以满足公司到2026年第二季度的预计运营需求。截至6月底,该公司有220名全职员工,计划到2024年底将员工总数增加到约230-260人。截至8月30日收盘,Geron公司总市值为28.63亿美元。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐
参考来源:
[1] CDE/NMPA官网
[2] 药融云数据库
[3] FDA/EMA/PMDA
[4] 相关公司公开披露(正文图片均来自企业官方,除非另有说明)
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论