
6月26日,来凯医药发布公告,来凯医药已在中国启动了LAE102的I期临床试验招募,并已完成首例受试者用药。该I期临床试验是一项随机、双盲、安慰剂对照研究,旨在评估该疗法的安全性、耐受性以及药代动力学。

LAE102是来凯医药自主研发的一种单克隆抗体,针对参与调控肌肉再生和脂代谢的新靶点ActRIIA。在临床前研究中,LAE102已显示出增加肌肉并减少脂肪的效果。LAE102与GLP-1受体激动剂联用可进一步减少脂肪并显著降低GLP-1受体激动剂导致的肌肉流失,使LAE102成为一种高质量体重控制候选药物,在减脂的同时保持肌肉质量。
LAE102在今年4月、5月分别获得FDA、NMPA用于治疗肥胖适应症患者的IND批准。
根据药物临床试验登记与信息公示平台显示,来凯医药在6月3日公开了一项评价LAE102注射液在健康成年受试者及超重/肥胖受试者中的安全性、耐受性及药代动力学的I期临床研究。本次I期临床试验目标入组人数为72人。
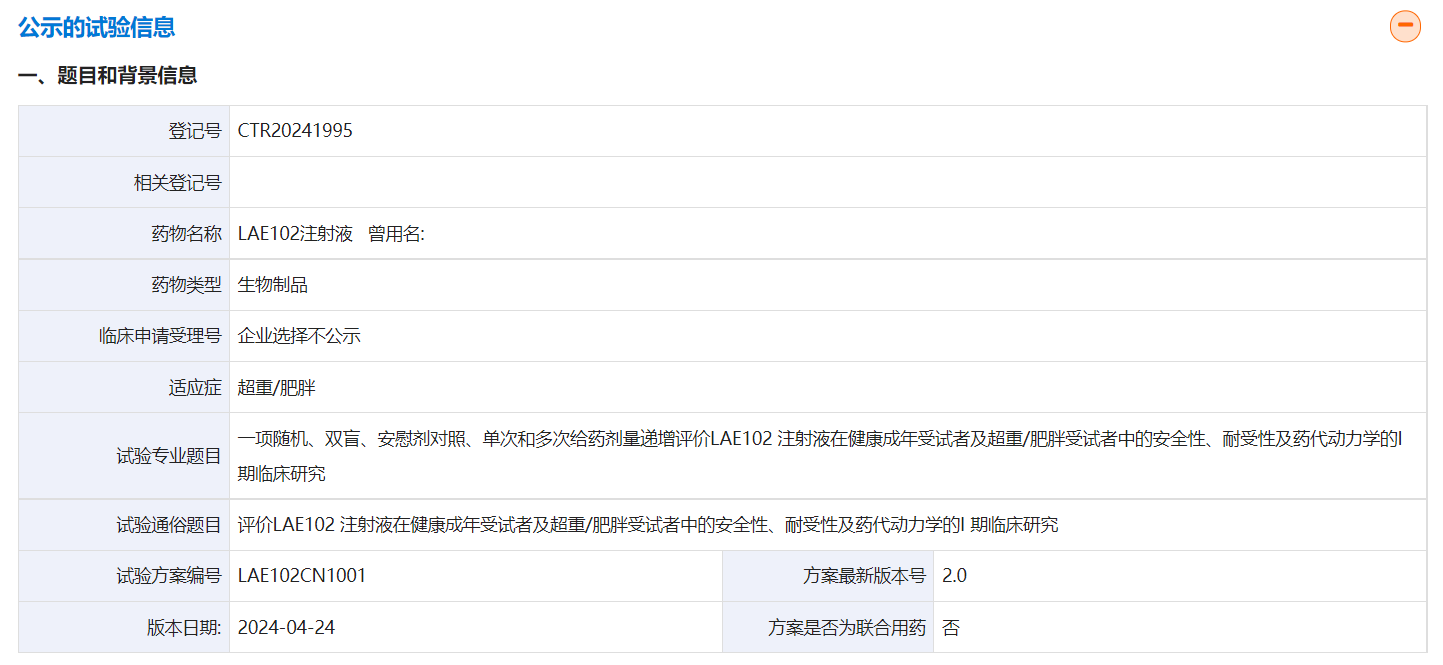
试验目的:
主要目的是评价在健康成年受试者中经静脉滴注/皮下注射单次给予不同剂量LAE102注射液后的安全性和耐受性;
次要目的是评价在健康成年受试者中经静脉滴注/皮下注射单次给予不同剂量LAE102注射液后的药代动力学(PK)特征和免疫原性(ADA)的情况。评价在健康成年受试者中给予不同剂量LAE102注射液后激活素A(ActivinA)变化。
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论