
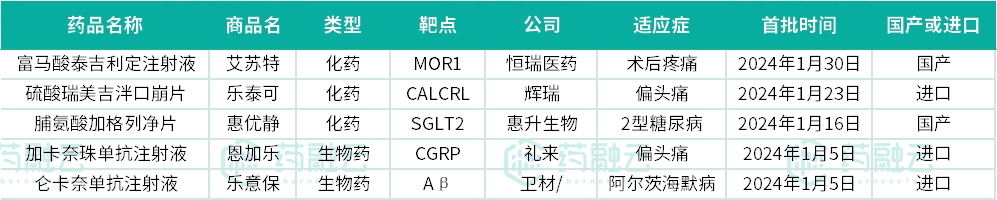
在开年来的第一个月内,已经有5款新药在国内成功获批,分别是卫材/渤健的仑卡奈单抗注射液(乐意保)、礼来的加卡奈珠单抗注射液(恩加乐)、惠升生物的脯氨酸加格列净片(惠优静)、辉瑞的硫酸瑞美吉泮口崩片(乐泰可)和恒瑞医药的富马酸泰吉利定注射液(艾苏特)。
来源:药融云中国药品审评数据
01国内首款阿尔茨海默症生物药:仑卡奈单抗注射液

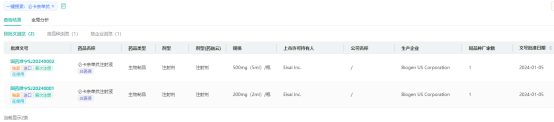
仑卡奈单抗是一种抗淀粉样蛋白(Aβ)原纤维抗体,同样由卫材和渤健联合开发。淀粉样蛋白沉积是AD患者大脑的标志性特征之一。仑卡奈单抗通过与可溶性Aβ聚合体结合,并且促进它们的清除,从而具有改变AD病理,缓解疾病进展的潜力。FDA曾授予此疗法快速通道资格、优先审评资格、突破性疗法认定等。2023年1月,FDA加速批准仑卡奈单抗用以治疗阿尔茨海默病,使其成为近年来靶向β淀粉样蛋白的第二款创新阿尔茨海默病疗法(2021年卫材/渤健研发的Aducanumab获批,为第一款)。
来源:药融云中国药品批文数据
根据2022年11月在《新英格兰医学杂志》(NEJM)上发表的3期Clarity AD试验结果,在近2000名早期阿尔茨海默病患者中,仑卡奈单抗显示在减少临床衰退方面具有高度显著统计学意义。在临床痴呆评分总和量表CDR-SB方面,试验组和安慰剂组较基线的平均变化分别为1.21和1.66分,试验组CDR-SB的临床衰退幅度与安慰剂组相比减缓27%。相比安慰剂组,治疗组所有关键次要终点也显示出统计学差异,包括专门衡量认知能力的指标ADAS-Cog14、AD综合评分ADCOMS以及用于评估患者日常生活能力的指标ADCS MCI-ADL等。在安全性方面,lecanemab组和安慰剂组分别有0.7%和0.8%的参与者死亡。研究者认为,没有死亡与lecanemab或与淀粉样蛋白相关成像异常(ARIA)有关。此外,lecanemab组和安慰剂组分别有14.0%、11.3%的参与者经历了严重的不良事件,88.9%和81.9%的参与者经历了不良事件。lecanemab组最常见的不良事件包括输液反应、ARIA-H(合并脑微出血、脑大量出血和浅表铁质沉积)、ARIA-E(水肿/积液)、头痛和跌倒。
国内市场中,除九期一(绿谷制药的甘露特钠胶囊,该药存在较大争议)外,已获批的药物以胆碱酯酶抑制剂为主,疗效普遍不足,只能短期控制疾病症状,难以针对明确病因机制入手延缓疾病进程。2023年1月,仑卡奈单抗已通过FDA的加速批准途径获批。同年7月,FDA宣布将该药转为常规批准。这也使该药成为20年来FDA首次完全批准的AD药物。此次仑卡奈单抗在国内获批,为庞大的阿尔茨海默症患者人群带来了新的治疗选择。
02重磅CGRP单抗,礼来偏头痛新药:加卡奈珠单抗注射液

加卡奈珠单抗是一种人源化IgG4型单克隆抗体,可与降钙素基因相关肽(CGRP)结合并阻断CGRP与其受体结合,从而达到预防偏头痛的治疗目的。该药最早于2018年9月获美国FDA批准上市,用于成人偏头痛的预防性治疗。2019年6月,FDA又宣布批准加卡奈珠单抗用于治疗阵发性丛集性头痛成人患者,可减少发作频率。

来源:NMPA官网
此次在中国获批成人偏头痛的预防性治疗主要基于一项加卡奈珠单抗针对中国患者的III期CGAX研究积极结果。CGAX研究是一项前瞻性、全球多中心、随机、双盲、安慰剂对照的3期研究,研究共纳入520名发作性偏头痛患者,以中国患者为主,患者以1:1的比例随机分配,在为期3个月的双盲治疗期间每月一次接受120mg加卡奈珠单抗(负荷剂量为240mg)或安慰剂治疗。
CGAX研究结果显示,在主要研究终点每月头痛天数(MHD)上,加卡奈珠单抗治疗组显著优于安慰剂组。在四个评估偏头痛对功能影响的关键次要终点,MSQ评分(生活质量评分)、50%缓解率(即头痛天数较基线水平改善达到50%或以上的患者比例)、75%缓解率和100%缓解率上,治疗组同样优于安慰剂组,与全球已完成的主要研究结果一致。此外,该研究还显示加卡奈珠单抗的安全性良好,不良事件的严重程度多为轻度到中度,未发生严重不良事件或死亡事件。
从2022年全球销售额来看,CGRP/CGRPR拮抗剂整体增速较2021年放缓,不过仍以26%的速度稳步攀升至31.71亿美元。艾伯维的Ubrelvy®、礼来的Emgality®、安进/诺华的Aimovig®以及辉瑞的Nurtec®占据主要市场份额,合计收入24.94亿美元,占比高达78.7%。期待该靶点赛道药物在国内能够为广大偏头痛患者带来新的治疗选择。
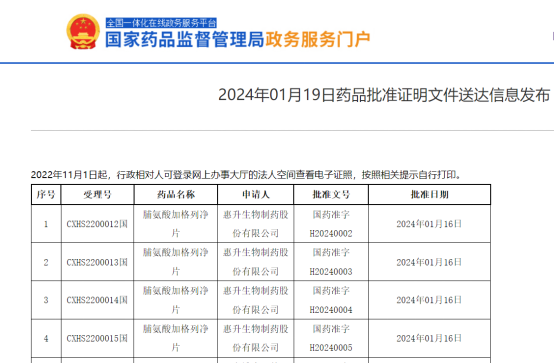
03国产第2款SGLT2抑制剂:脯氨酸加格列净片

脯氨酸加格列净是一种钠-葡萄糖协同转运蛋白2(SGLT2)抑制剂,通过抑制SGLT2,减少滤过葡萄糖的重吸收,降低葡萄糖的肾阈值,从而增加尿糖排泄。该药品的上市为成人2型糖尿病患者提供了新的治疗选择。加格列净片是SGLT-2抑制剂类国家Ⅰ类创新药,该产品在有效控制血糖的同时,在心血管和肾脏保护方面也具备潜在获益,目前已经获得中国、美国、欧洲、日本、韩国、香港等多个国家和地区共28项专利权。加格列净由四环医药(0460.HK)非全资附属公司惠升生物自主研发,于2012年确定分子,历经12年的时间,研发投入达数亿元,最终于2024年获批上市。
来源:NMPA官网
脯氨酸加格列净的临床III期研究数据显示,其不仅具有显著的降糖疗效(糖化血红蛋白的下降较基线最多达1.4%),同时具有降低血压、减轻体重、改善血脂等多重获益,低血糖风险低,总体安全性良好。与已上市的同类SGLT-2抑制剂产品III期临床数据结果横向比较,加格列净显示出了相似甚至更优的结果。
2021年底,恒瑞自主研发新药恒格列净获批,成为首个国产SGLT2新药,该产品很快通过国谈进入医保,有望迅速放量。中国的糖尿病患者人多,市场大,药物多,但由于价格、准入等原因,新型降糖药普及率仍然不高,如SGLT2、DDP4、GLP-1等药物,市场份额相对较低,和欧美发达国家相比,还有很大差距。期待能有更多糖尿病患者用上更优质的治疗选择。
04新一代重磅口服CGRP 受体拮抗剂:硫酸瑞美吉泮口崩片

瑞美吉泮,即Rimegepant,通过可逆地阻断CGRP受体来靶向偏头痛的关键成分,从而抑制导致偏头痛发作的生物级联反应。瑞美吉泮是目前首个也是唯一一个CGRP受体拮抗剂口崩片剂型,具有服用方便、起效快、生物利用度高的优点,能够有效阻断偏头痛发病相关的关键通路,快速且持续缓解头痛及相关伴随症状,服用方式便捷,且无心血管疾病禁忌症等影响。2020年2月,该药在美国首次获批,2021年5月又获批扩展适应症。此后,于2022年4月在欧洲获批上市。是全球首个且唯一一个被美国FDA和欧盟批准可同时用于偏头痛急性治疗和预防性治疗的创新药物。
辉瑞在2021年11月以总额12.4亿美元与 Biohaven达成合作,获得了两款CGRP拮抗剂的权益,包括口服偏头痛药物瑞美吉泮(Nurtec ODT)在美国以外的权益,以及Zavegepant(同时在开发鼻内+凝胶双剂型)的美国地区权益。后续于2022年5月,辉瑞又以116亿美元收购Biohaven,两笔交易足以显示MNC对CGRP靶向药的看好。

瑞美吉泮口崩片是首个在中国的关键试验中显示出积极结果的口服CGRP受体拮抗剂。该项研究中,患者单剂量口服75mg药物2小时后达到了疼痛和最困扰症状缓解的共同主要终点。患者可在45分钟内迅速缓解疼痛和消除最困扰症状,60分钟内恢复正常功能,90分钟内消除疼痛;对多数患者而言,其持续疗效可达48小时;同时表现出良好的安全性和耐受性,与之前在美国的临床试验结果一致。
从2020年3月正式商业推出到2021年12月31日,瑞美吉泮销售额已达5.26亿美元。在商业化方面,口服药物有极强的便捷性和低成本,优势明显。不过在国内市场,CGRP的药物价格与曲坦类药物相比更贵不少,这些新药在国内的市场并非一片坦途,值得我们持续关注。
05中国首个自研阿片类镇痛创新药:富马酸泰吉利定

富马酸泰吉利定是一种阿片受体完全激动剂,对阿片受体μ亚型(MOR)具有相对的选择性,按照麻醉药品管理。研究数据显示,该药物不仅镇痛效果显著,起效速度快,能有效延缓术后疼痛反弹需补充镇痛的时间;并且在保证镇痛效果的同时,大幅降低了恶心、呕吐和呼吸抑制等常见不良反应的发生率,极大地提升了患者的治疗舒适度和安全性。

来源:NMPA官网
2021年12月,恒瑞医药宣布,评估泰吉利定注射液的3期临床研究(SHR8554-301)主要研究终点结果达到方案预设的优效标准,该研究评估了泰吉利定用于腹部手术后镇痛的有效性和安全性。本研究共入组528例受试者,手术结束后的4小时内任意时刻静息状态下疼痛评分≥4分的受试者按照1:1:1:1随机进入泰吉利定注射液0.75mg组、SHR8554注射液1.0mg组、吗啡组或安慰剂组接受治疗。研究结果表明,泰吉利定注射液能够有效治疗腹部手术后中重度疼痛,显著提高受试者对镇痛治疗的满意度。
除腹部手术后中重度疼痛外,泰吉利定此前还启动了针对一项骨科术后镇痛的 II/III 期临床试验(登记号:NCT05375305/CTR20220639),2022年 2 月已完成受试者的招募工作。2023年12 月 29 日,据 CDE 官网显示,恒瑞富马酸泰吉利定注射液用于骨科术后镇痛的适应症申报上市。该药品的上市为手术后中重度疼痛患者提供了新的治疗选择,期待其新适应症也早日获批。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论