
据药融云数据库显示,在2023开年来,已经有2款1类新药获得国家药监局的批准上市,分别是江苏艾迪药业的抗HIV病毒复方制剂艾诺米替片(复方ACC007片)和武田制药的琥珀酸莫博赛替尼胶囊(Mobocertinib胶囊)。这2款1类新药获批上市后将分别为艾滋病患者和携带EGFR外显子20插入突变阳性的晚期非小细胞肺癌患者提供新的治疗选择。(注:派安普利单抗注射液属于新适应症获批,不纳入统计)

(来源:药融云中国药品审评数据)
一、新年首款1类新药获批上市!来自艾迪药业的首个国产三合一艾滋病新药

2023年1月4日,药监局官网显示,艾迪药业递交的1类新药获批上市。艾诺米替片(商品名:复邦德)为艾诺韦林、拉米夫定和富马酸替诺福韦二吡呋酯组成的复方制剂,用于治疗成人HIV-1感染初治患者。
这是2023年第一款获得国家药监局批准上市的1类新药,同时也是国产首个三合一(三种成分形成的单片给药)艾滋病新药。
艾诺米替片核心成分艾诺韦林为第三代非核苷类逆转录酶抑制剂(NNRTIs),通过非竞争性结合并抑制HIV逆转录酶活性,从而阻止病毒转录和复制,是艾迪药业创新药领域最为重要的业务方向,具有安全强效,提高患者生活质量的优势。
根据III期临床研究试验结果显示,艾诺韦林片在安全性上表现优异,能显著减少头晕、睡眠障碍等中枢神经系统不良反应、脂代谢指标控制良好、肝毒性低和皮疹发生率低;其抗病毒有效性与对照组的依非韦伦相当,能够快速降低患者体内病毒载量,对高低基线病毒载量均抑制有效且疗效持续稳定。
艾诺米替片国内登记的临床试验

(数据来源:药融云中国临床试验数据)
此次获批的艾诺米替片适应症主要针对HIV初治患者。目前,公司针对经治患者的III期临床试验正顺利开展,762例临床受试者的入组工作已于2022年3月末全部完成,目前临床试验工作正按计划有序推进中。随着公司两大核心抗HIV产品艾邦德®与复邦德®的上市,也将进一步完善艾迪药业抗艾诊疗一体化患者服务范式,在短时间内快速地缩短国内HIV诊疗与发达国家水平之间的差距。
二、国内首款用于EGFR Exon20插入突变NSCLC的1类新药获批上市!

2023年1月11日,武田制药公司申报的1类新药获批上市——琥珀酸莫博赛替尼胶囊(商品名:安卫力/EXKIVITY,TAK-788)上市,此次为国家药监局通过优先审评审批程序附条件批准。该药适用于含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是国内获批上市的首款用于EGFR Exon20插入突变NSCLC的疗法,实现国内该领域零的突破。
EGFR突变是中国NSCLC患者最常见的突变类型,其中,EGFR Exon20虽然属于非经典突变(约占所有NSCLC的1%~2%),由于中国肺癌患者基数庞大,因此EGFR 20ins突变并不“罕见”。携带这种基因突变的患者比其他EGFR突变患者预后更差,现有的EGFR酪氨酸激酶抑制剂和化疗为这些患者带来的获益有限。
莫博赛替尼是一种专门设计用于选择性靶向EGFR Exon20插入突变的强效口服小分子酪氨酸激酶抑制剂,于2021年9月获得美国FDA批准,用于含铂化疗治疗中或治疗后疾病出现进展的EGFR Exon20晚期NSCLC。在中国,莫博赛替尼曾先后于2020年9月和2021年7月获得CDE突破性治疗品种和优先审评认定。
mobocertinib化学结构式

(图片来源:medchemexpress.cn)
莫博赛替尼的获批主要基于1/2期研究(NCT02716116)结果,该研究曾在2021年世界肺癌大会(WCLC)上进行口头报告,并发表在JAMA Oncology杂志上。
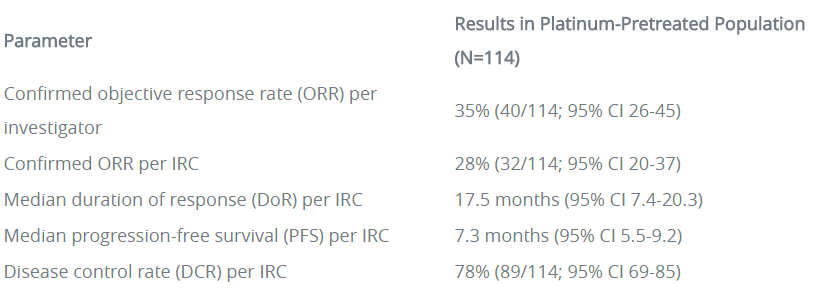
临床数据显示,莫博赛替尼160mg QD治疗114例铂类化疗经治患者(PPP队列,包括6例剂量递增队列+22例剂量扩展队列1+86例EXCLAIM队列患者),独立审查委员会(IRC)确认的ORR为28%,研究者确认的ORR为35%。并且,无论插入突变发生在近环(near-loop)或远环(far-loop),ORR都相似,分别为29%和25%。莫博赛替尼起效迅速且疗效持久,中位起效时间为1.9个月,中位缓解持续时间(DoR)为17.5个月。中位OS为24个月,中位无进展生存期(PFS)为7.3个月。
安全性方面,莫博赛替尼最常见的治疗相关不良事件(TRAE)为腹泻和皮疹,腹泻是唯一在超过10%的患者中报告的3或4级TRAE。大多数胃肠道和皮肤不良事件为1或2级,均可通过支持治疗、剂量调整和/或停药处理。
根据中国药物临床试验登记与信息公示平台,武田制药开展了一项有关莫博赛替尼的III期临床试验,试验目的为:在肿瘤携带EGFR 20号外显子插入突变的局部晚期或转移性NSCLC患者中比较TAK-788作为一线治疗与含铂化疗的疗效,由设盲的独立审查委员会(IRC)根据实体瘤疗效评价标准(RECIST)1.1版评估的无进展生存期(PFS)证实。期待该药更好的服务国内肺癌患者。

(来源:药融云中国临床试验数据)
值得一提的是,在EGFR Exon20这个赛道上,迪哲医药的舒沃替尼片(DZD9008)的新药上市申请与今年1月10日获国家药品监督管理局受理并纳入拟优先审评。此次申请基于舒沃替尼首个中国注册临床研究(悟空6,WU-KONG6),其结果在2022年欧洲肿瘤内科学会(ESMO)大会公布:截至2022年7月31日,由盲态独立中心评估委员会(BICR)评估确认的肿瘤缓解率(cORR)为59.8%,针对基线伴稳定、无症状脑转移的EGFR exon20ins突变患者cORR达48.4%,展现出全球同类最优的疗效,且整体安全性良好。
其余布局EGFR Exon20赛道的国内企业还有再鼎医药、君境生物、福沃药业等。期待这些国产新药能与莫博赛替尼同台竞技,为国内患者带来优质安全、性价比高的治疗选择。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

—END—




























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论