
TRUSELTIQ™ (infigratinib) 是一种口服FGFR1-3选择性抑制剂,此前在2021年5月28日美国FDA已加速批准用于既往接受过治疗的、不可切除的局部晚期或转移性胆管癌,且患者需经FDA批准的检测方法确认带有FGFR2融合或FGFR2重排。

截图来源:药融云数据,www.pharnexcloud.com
TRUSELTIQ™靶向FGFR蛋白,阻断下游活性。在临床研究中,TRUSELTIQ™ 显示出具有临床意义的肿瘤缩小率(总体缓解率约23%)和缓解持续时间。

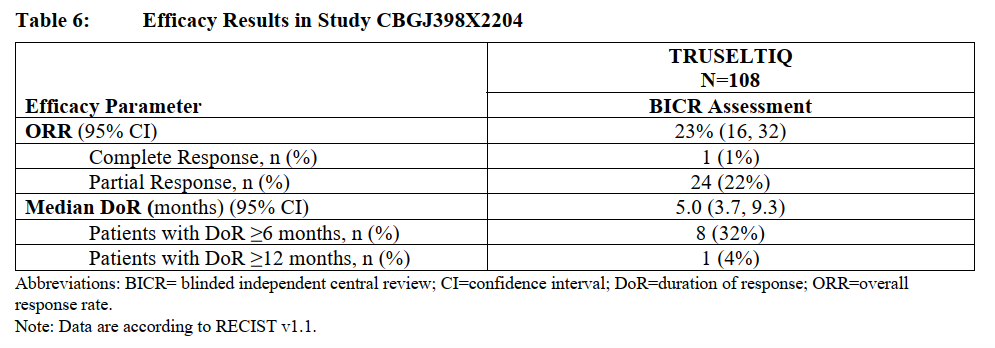
Infigratinib图示以及说明书,https://www.truseltiq.com/
联拓生物于2020年获得BridgeBio Pharma授权,目前仍拥有在中国大陆、香港和澳门对infigratinib (暂定译名:英菲格拉替尼)进行开发和商业化的权利。
infigratinib药物基本信息
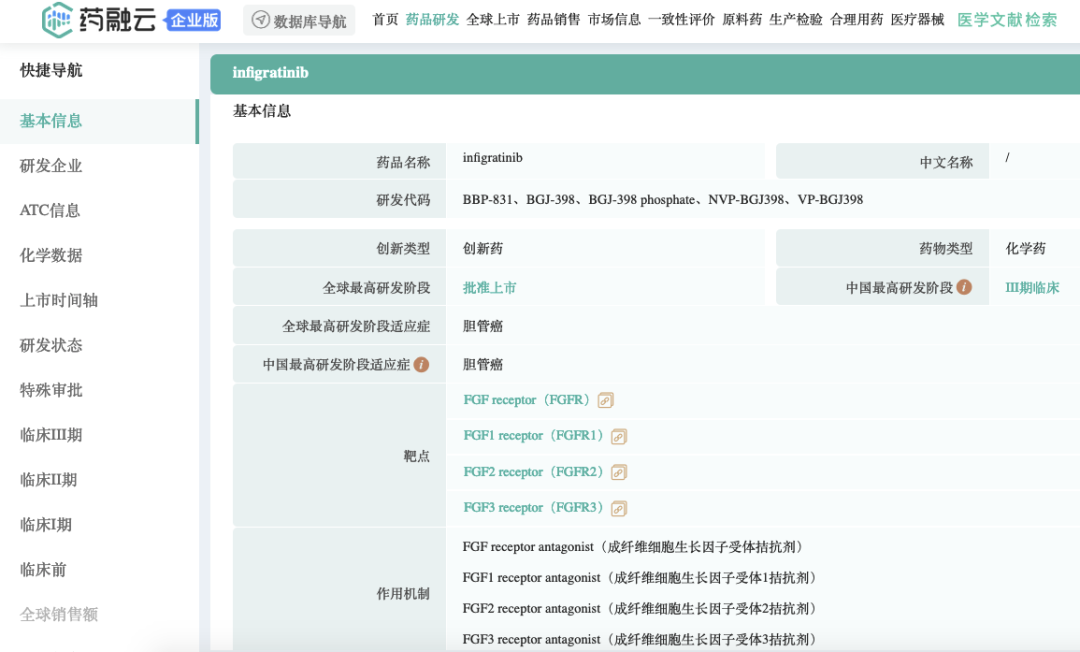
截图来源:药融云全球药物研发数据库
Infigratinib/英菲格拉替尼相关专利:WO-2006000420。本品最早由Novartis (诺华)开发,发明人包括多位华人科学家;相关合作伙伴包括QED Therapeutics/BridgeBio Pharma(2018年开展合作)、Helsinn Group(瑞士赫尔森)、联拓生物等等。目前获批上市的国家有美国、加拿大、澳大利亚。
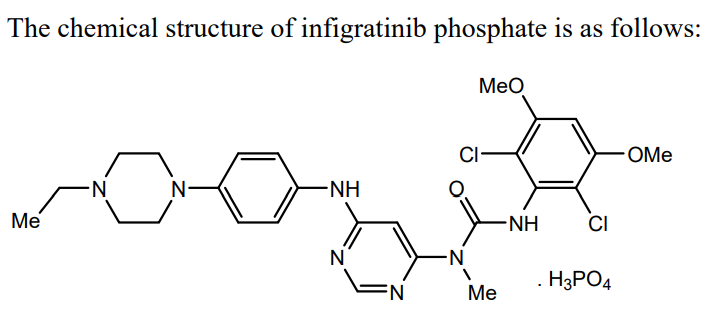
2021年12月,英菲格拉替尼经海南省卫生和健康委员会和海南省药品监督管理局批准,用于治疗携带FGFR2基因融合或重排且既往接受过治疗的、不可切除的局部晚期或转移性胆管癌患者。中国首例获准特许使用英菲格拉替尼的患者在海南乐城博鳌超级医院接受了治疗。这也是英菲格拉替尼在北美以外开出的首个处方。

截图来源:药融云中国临床试验数据库
联拓生物目前正在中国进行临床试验,以评估英菲格拉替尼在伴有FGFR2基因扩增的局部晚期或转移性胃癌或胃食管结合部腺癌患者,以及因FGFR基因变异导致的其他晚期实体瘤患者中的安全性和有效性。
2022年10月,Helsinn Group基于商业计划考量,宣布撤回infigratinib在美上市申请;计划于2023年3月31日停止供应。要知道,Helsinn Group仅在7个月前获得本品在美国肿瘤适应症权益(扩大了于2021年3月的合作计划)。



分析人士认为:目前在美国上市获准的适应症限制比较窄。Helsinn尝试推广后认为本品商业化投入产出比不高。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
BridgeBio,https://bridgebio.com/our-products/;
联拓生物(LianBio);
Targeted Agents Show Promise in Cholangiocarcinoma (onclive.com);
https://helsinn.com/;
https://www.truseltiq.com/;
https://www.biospace.com/article/releases/helsinn-group-and-bridgebio-pharma-announce-update-to-strategic-collaboration-to-develop-manufacture-and-commercialize-infigratinib-in-oncology-indications-in-the-u-s-/?s=61;
Helsinn to develop and commercialize QED Therapeutics' infigratinib for cancer and other indications, outside of the US, excluding China, Hong Kong and Macau,March 2021;等等。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论