
9月16日,据CDE官网,正大天晴的3.3类新药达雷妥尤单抗注射液临床申请获受理,是国内第2家申报该西安杨森制药$60亿单抗药物临床的药企。2021年1月,NMPA正式批准了复宏汉霖的达雷妥尤单抗生物类似药HLX15(重组抗CD38全人单克隆抗体注射液)的临床试验申请,用于多发性骨髓瘤(MM)的治疗。
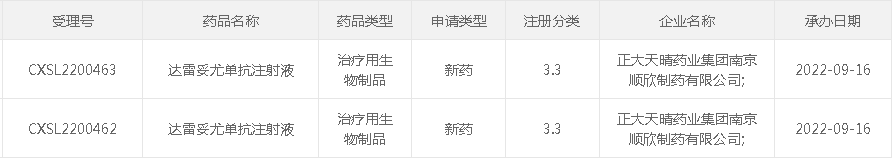
截图来源:CDE官网
达雷妥尤单抗(daratumumab)为西安杨森制药的重磅单抗药物,是全球首个获批的靶向作用于CD38的全人源单克隆抗体。该药最早在2015年11月获FDA批准在美国上市,2019年7月在中国获批进口。研究显示,达雷妥尤单抗能够以高亲和力的方式,特异性识别在多发性骨髓瘤恶性浆细胞上高表达的CD38,进而通过多种免疫介导机制来诱导肿瘤细胞的死亡。
据药融云统计,达雷妥尤单抗2021年在全球的销售额超60亿美元,同比增长44%,业绩预期依然十分积极。而在国内,达雷妥尤单抗也正在快速扩容中,2022年第一季度院内销售额已达1.1亿元,同比增长460%。
达雷妥尤单抗院内销售情况(微信搜索"药融云小程序"查看更多维度数据分析)
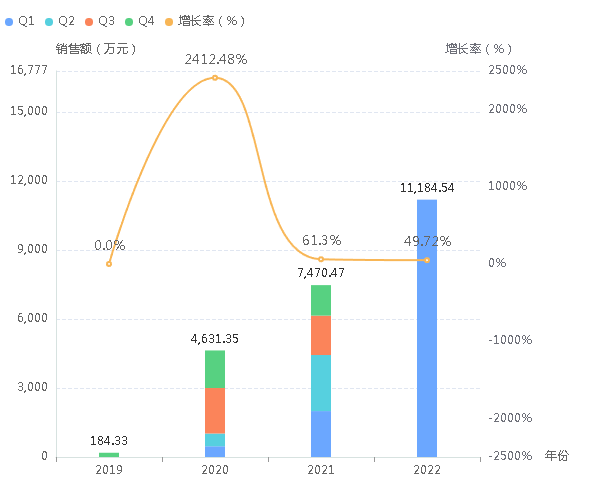
截图来源:药融云全国医院销售数据库
据药融云数据库显示,目前国内仅有原研西安杨森制药获批生产达雷妥尤单抗,有皮下注射剂和静脉注射剂两种。
西安杨森制药达雷妥尤单抗药品批文信息

截图来源:药融云中国药品批文数据库
其中,达雷妥尤单抗的皮下注射剂用于与硼替佐米、环磷酰胺和地塞米松联合用药治疗新诊断的原发性轻链型淀粉样变患者。今年4月,该品种又递交了一项新适应症上市申请,尚在审评审批中。
达雷妥尤单抗的静脉注射剂适用于(1)与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药治疗既往至少接受过一线治疗的多发性骨髓瘤成年患者;(2)单药治疗复发和难治性多发性骨髓瘤成年患者,患者既往接受过包括蛋白酶体抑制剂和免疫调节剂的治疗且最后一次治疗时出现疾病进展。
在强生旗下西安杨森制药8月27日最新公布的一项关键II期GRIFFIN研究的最终分析结果中,达雷妥尤单抗+RVd一线治疗多发性骨髓瘤II期结果积极。据悉,西安杨森制药对达雷妥尤单抗还开展了针对AL型淀粉样变性、急性B淋巴细胞白血病、骨髓增生异常综合征等多项适应症的临床试验,后续有望不断拓宽适应症。
达雷妥尤单抗适应症研发现状
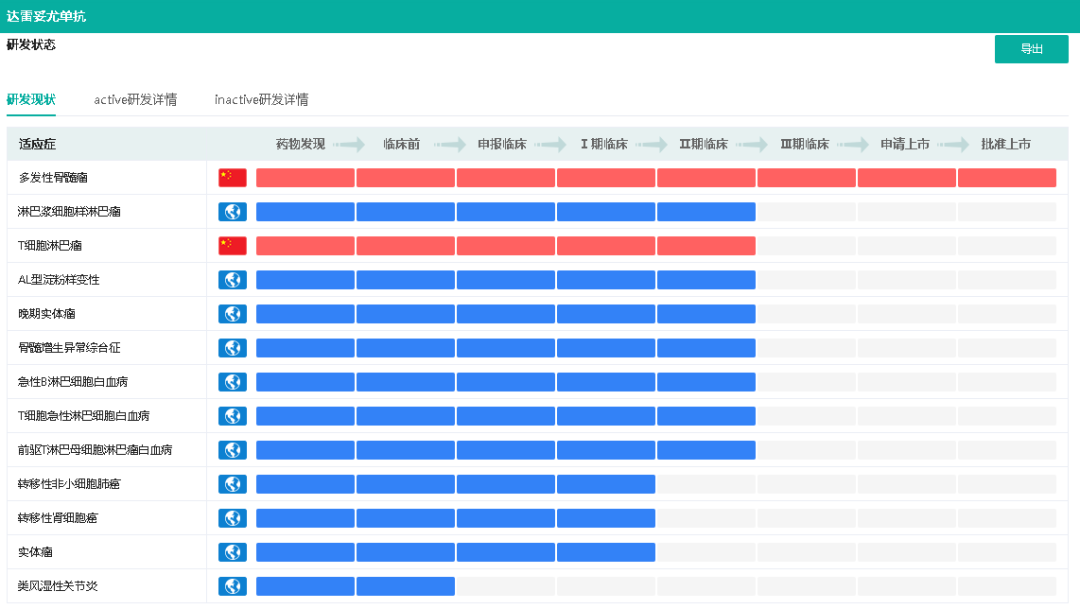
截图来源:药融云全球药物研发数据库
目前,正大天晴共有两款单抗药物获批上市,分别为阿达木单抗注射液和派安普利单抗注射液,其中前者已于2021年纳入国家医保目录。此外,正大天晴还递交了注射用曲妥珠单抗、利妥昔单抗注射液、贝伐珠单抗注射液三款单抗药物的上市申请,正在审评审批中。
参考来源:
[1] CDE官网
[2] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论