
引言
2022年7月19日,阿斯利康发布声明宣布,其与第一三共合作的HER2靶向ADC药物Enhertu(DS-8201)在欧盟获得批准,作为单一疗法,用于接受一种或多种先前基于抗HER2的方案治疗的HER2阳性转移性乳腺癌患者。此次批准将Enhertu在欧洲的适应症扩大到早期用于HER2阳性转移性乳腺癌。
在获得欧盟批准后,阿斯利康将向第一三共支付7500万美元,作为HER2阳性转移性乳腺癌二线治疗的里程碑付款。该里程碑将作为阿斯利康2019年向第一三共支付的预付款及后续资本化里程碑的补充资本化,并将通过损益表摊销。
关于Enhertu
Enhertu药物基本信息

截图来源:药融云全球药物研发数据库
据药融云数据库显示,Enhertu是阿斯利康与第一三共合作研发的HER2靶向的ADC药物。该药物有多项适应症处于研发中,比如转移性乳腺癌、转移性胃癌、转移性卵巢癌、转移性食管癌、转移性非小细胞肺癌等,目前前2项适应症已获批上市。Enhertu最早于美国2019年12月上市,获批适应症为转移性乳腺癌。2021年1月,转移性胃癌适应症又获美国FDA获批。
Enhertu适应症研发现状
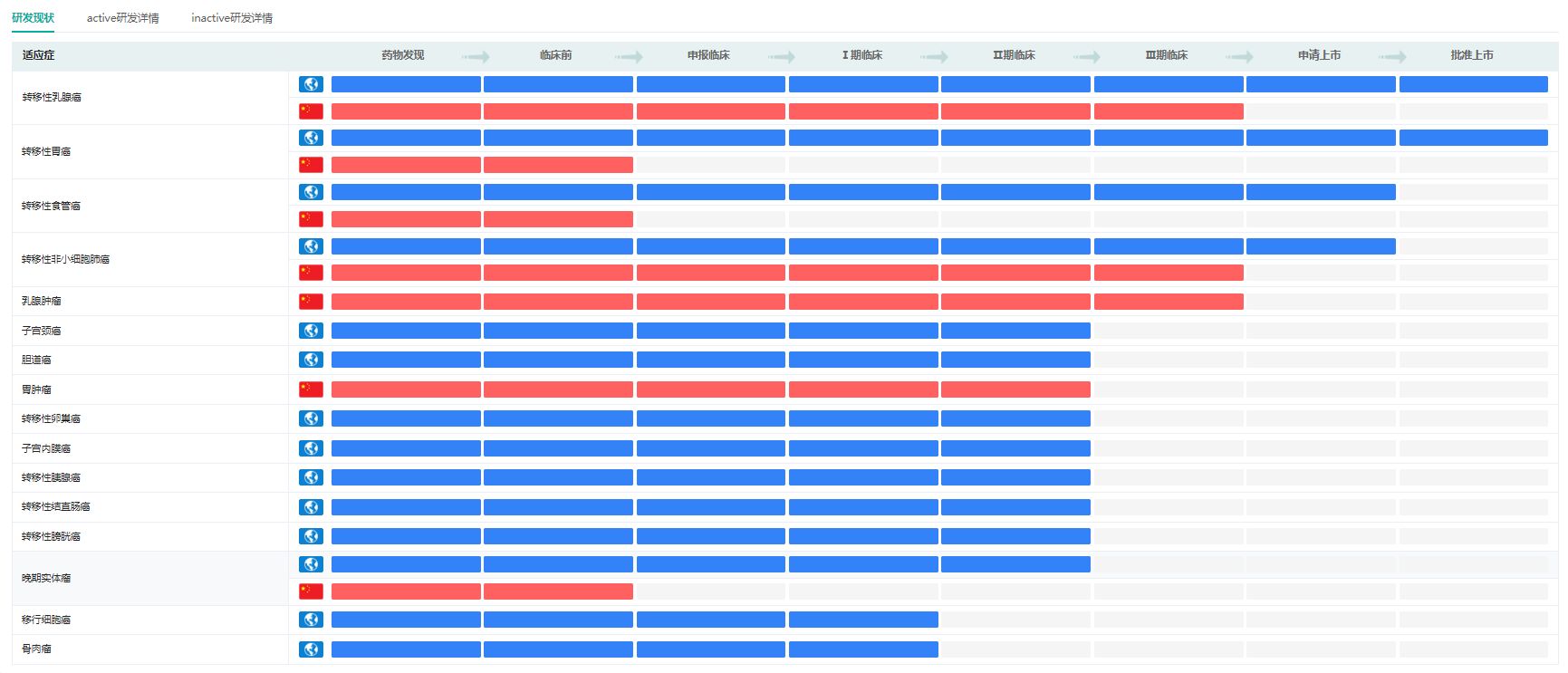
截图来源:药融云全球药物研发数据库
获批基于
欧盟委员会(EC)的批准遵循人用医药产品委员会的积极意见,并基于DESTINY-Breast03 III期试验的结果,该试验发表在《新英格兰医学杂志》上。在试验中,与曲妥珠单抗(T-DM1)相比,Enhertu将患者(HER2阳性不可切除和/或转移性乳腺癌,之前接受过曲妥珠单抗和紫杉烷治疗)的疾病进展或死亡风险降低了72%(风险比[HR]0.28;95%置信区间[CI]0.22-0.37;p<0.000001)。

DESTINY-Breast03 III期试验的其他结果表明,在总生存期(OS)的次要终点中,Enhertu存在改善OS的强烈趋势(HR0.55;95%CI0.36-0.86),但该分析并非如此尚未成熟,进一步的后续行动正在进行中。几乎所有接受Enhertu治疗的患者(96.1%)在9个月时存活,而接受T-DM1治疗的患者为91.3%。Enhertu组与T-DM1组相比,确认的客观缓解率(ORR)增加了一倍以上(79.7%对34.2%)。
基于DESTINY-Breast03的结果,欧洲医学肿瘤学会临床实践指南于2021年10月更新,建议将Enhertu作为紫杉烷和紫杉烷进展后HER2阳性转移性乳腺癌患者的首选二线治疗。
作为此次批准的一部分,欧盟还将Enhertu在这种情况下的市场保护期延长了一年,因为与现有批准的疗法相比具有显著的临床益处。
国内上市情况
今年3月21日,第一三共向CDE提交了Enhertu的NDA申请,仅一月之隔,4月24日,Enhertu(trastuzumab deruxtecan)就被纳入优先审评。相信Enhertu的国内获批也不会太远。

小结
目前市场上的ADC药物多数是基于HER2靶点开发,结构上参考了罗氏的T-DM1。基于强大的HER2阳性及低表达患者治疗效果,Enhertu的上市,给ADC市场带来了鲶鱼效应,迫使药企不断提高研发技术,推出效果更好的ADC药物。
参考来源:
[1] CDE官网
[2] 药融云数据库
[3] 阿斯利康官网
[4] Trastuzumab Deruxtecan versus Trastuzumab Emtansine for Breast Cancer
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论