


2月11日,国家药监局根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准辉瑞公司新冠病毒治疗药物奈玛特韦片/利托那韦片组合包装(即Paxlovid)进口注册。
辉瑞公司的Paxlovid是一种新型分子PF-07321332和HIV抗病毒药物利托那韦的组合。两者都属于 “蛋白酶抑制剂”的抗病毒药物,它阻断了对病毒复制至关重要的一种酶(3CL蛋白酶)的活动。本品为口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒肺炎(COVID-19)患者,例如伴有高龄、慢性肾脏疾病、糖尿病、心血管疾病、慢性肺病等重症高风险因素的患者。患者应在医师指导下严格按说明书用药,使用中应高度关注说明书中列明的与其他药物相互作用信息。
辉瑞Paxlovid基本信息
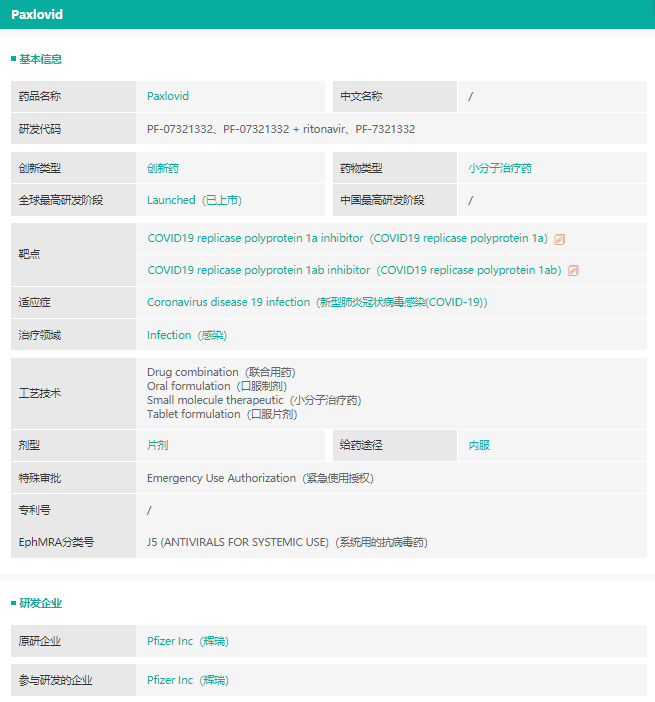
截图来源:药融云全球药物研发数据库
国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
此前,在美国时间2021 年 12 月 22 日,FDA授予了辉瑞 (Pfizer) 新型抗病毒药 Paxlovid(PF-07321332) 紧急使用授权(EUA),该药将用于患重症 COVID-19 的高风险人群。这也是新冠领域首个获准在家使用的疗法。Paxlovid的紧急获批基于此前EPIC-HR临床研究的结果:可将感染COVID-19患者的住院或死亡的风险降低89%。《FDA紧急授权2款口服新冠药物 :默沙东molnupiravir、辉瑞Paxlovid!》
















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论