
2022年1月9日,广生堂发布公告,旗下子公司福建广生中霖生物科技有限公司的3CL蛋白酶抑制剂1类创新药GST-HG171(拟定中文通用名“泰阿特韦”)联合利托那韦(合称“泰中定”)取得阶段性进展,且疗效优于辉瑞的3CL蛋白酶抑制剂——Paxlovid。
研究者发起了在广州医科大学附属第一医院、深圳市第三人民医院开展的临床试验(IIT),现已完成全部受试者入组和临床观察,并于近日取得临床研究总结报告。研究结果显示泰中定(GST-HG171片/利托那韦片)具有优越的抗新冠病毒疗效,新冠患者核酸转阴时间明显优于阳性对照Paxlovid及安慰剂对照,同时安全性和耐受性良好,达到试验预期目的。为后期药物上市提供重要佐证,是公司新冠药物研发的重大进展。

一、广生堂:位列国内3CL蛋白酶抑制剂研发第一梯队
3CL蛋白酶(3C-likeprotease,3CLpro)是在病毒自身编码中剪切和加工RNA的主要蛋白酶,目前已在12种病毒中发现。目前,人们对SARS病毒和COVID-19(SARS-COV-2)病毒的3CL蛋白酶结构研究最多,尤其是COVID-19病毒,目前已有167条晶体结构数据。从新冠药物研发的布局来看,有靶向病毒蛋白和靶向宿主蛋白两条设计思路,其中靶向病毒蛋白的路径包括RdRp(RNA依赖的RNA聚合酶)和3CLpro(3CL蛋白酶)。由于病毒的3CL蛋白酶和人的3CL蛋白酶的切割位点不一样,所以设计药物的特异性更好,潜在可设计出特异性更好的药物。
GST-HG171片是广生堂具有全球自主知识产权的强效、广谱、安全性优异的抗新冠病毒3CL蛋白酶抑制剂,其II/III期关键性注册临床试验正在积极招募患者入组中,旨在评估GST-HG171片联合Ritonavir片在轻型/普通型新型冠状病毒肺炎(COVID-19)患者中的国际多中心、随机、双盲、安慰剂对照的有效性和安全性。目前,该项目快速在广东、北京、上海、武汉、福建等约30个主要医疗机构开展相关注册临床研究。

(图片来源:广生堂公司官网)
据药融云数据库查询显示,截止目前,国内一共有三款小分子新冠口服药上市(《国内上市的新冠口服药大盘点:Paxlovid,阿兹夫定,莫诺拉韦》),分别是辉瑞的Paxlovid(奈玛特韦片/利托那韦片组合包装),真实生物的阿兹夫定片,以及默沙东的莫诺拉韦胶囊。其中,Paxlovid就是一款3CL蛋白酶抑制剂,2022年2月12日,被中国国家药监局应急批准进口注册,是国内第一款上市的新冠口服药,被冠以“特效药”之名,寄托了许多人结束新冠疫情的希望。另外,除了Paxlovid,在日本还有一款3CL蛋白酶抑制剂已上市,来自盐野义的ensitrelvir。
全球已上市的3CL蛋白酶抑制剂(微信搜索"药融云小程序"进行相关更多数据查询)
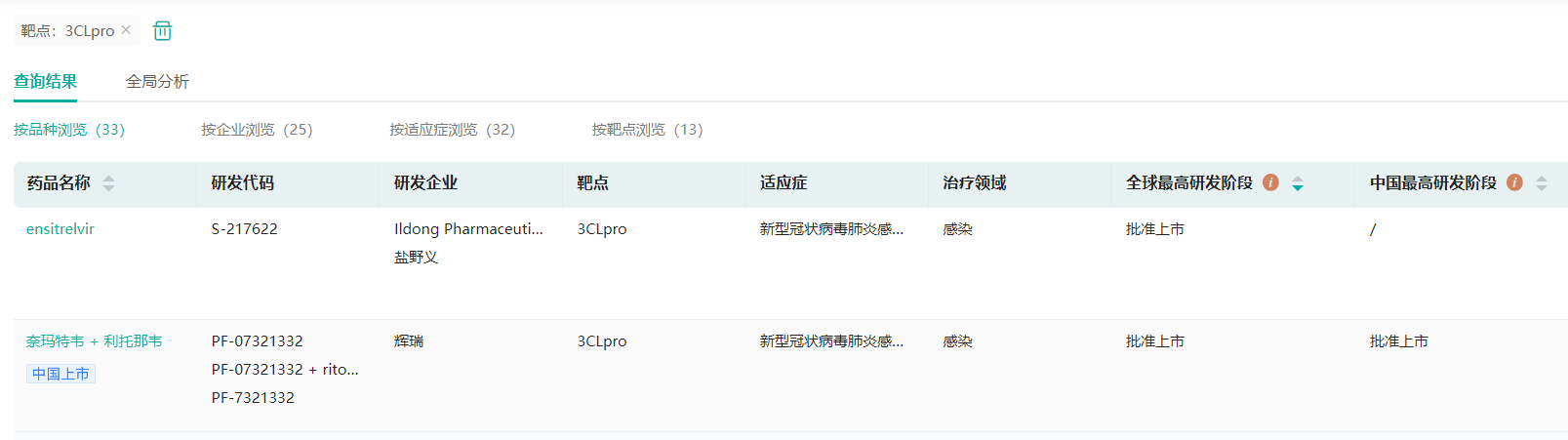
截图来源:药融云全球药物研发数据库
国内在研3CL蛋白酶抑制剂的抗新冠病毒口服小分子药物领域中,除广生堂外,还有先声药业、众生药业、前沿生物等十多家企业展开相关研究。其中,先声药业、众生药业、广生堂等企业进度领先,位列国产3CL蛋白酶抑制剂研发的第一梯队。
二、GST-HG171试验数据优秀!明显优于Paxlovid
在2023年1月9日发布的公告中,GST-HG171片在广州医科大学附属第一医院、深圳市第三人民医院开展的一项IIT研究中,于2022年11月22日~12月29日完成61例COVID-19患者招募和治疗,现全部受试者完成28天临床观察并出组。根据临床方案和统计分析计划制定的分析方法,本IIT期临床试验研究结果达到试验预期目的,泰中定在缩短新冠患者核酸转阴时间上明显优于阳性对照Paxlovid和安慰剂对照。
试验数据
泰中定(试验组)中位转阴时间为8.4天,Paxlovid(阳性对照组)中位转阴时间为9.5天,安慰剂组中位转阴时间为10.3天。泰中定(试验组)的活性成分泰阿特韦GST-HG171(150 mg)在只有Paxlovid的活性成分奈玛特韦(300 mg)一半的剂量下核酸转阴时间明显短于Paxlovid(阳性对照组)和安慰剂组。3泰中定(试验组)第5天核酸阳性率开始下降,第15天之后所有受试者的核酸结果均为阴性。Paxlovid阳性对照组和安慰组第6天时核酸阳性率开始下降,第16天之后所有受试者的核酸结果均为阴性。泰中定(试验组)核酸阳性率开始下降的时间早于Paxlovid阳性对照组和安慰剂组,且所有受试者均转阴的时间早于Paxlovid阳性对照组和安慰剂组。

(数据来源:公司公告)
此前2022年12月11日,广生堂发布公告,称其子公司广生中霖的口服小分子广谱抗新型冠状病毒3CL蛋白酶抑制剂1类创新药物GST-HG171片I期临床试验已完成全部受试者入组和临床观察并于近日取得临床研究总结报告。
结果显示,GST-HG171具有良好的安全性、耐受性和药代动力学特征,达到试验预期目的,为即将开展的II/III期临床研究提供了重要依据。

本研究为随机、双盲、安慰剂对照、单次、多次给药的剂量递增研究,旨在评价空腹条件下单次、多次服用GST-HG171片(或GST-HG171片联合利托那韦)后的安全性和耐受性、药代动力学特征、评估食物对GST-HG171(或GST-HG171联合利托那韦Ritonavir)药代动力学特征的影响以及初步探索GST-HG171(或GST-HG171联合利托那韦)的药物代谢转化。
试验数据
结果显示,健康受试者单次口服GST-HG171,血浆中GST-HG171暴露量随给药剂量增加而增加。相同给药剂量下GST-HG171单次给药的峰浓度或暴露量为文献报道的同等剂量Nirmatrelvir的2.6-3.0倍。与利托那韦联合给药可降低GSTHG171清除率,显著增加GST-HG171血浆暴露量,且明显提高其稳态浓度。连续给药5天低剂量GST-HG171联合利托那韦的峰浓度、谷浓度、稳态暴露量的PK数据与文献报道成倍高剂量Nirmatrelvir联合利托那韦数据相当,数据支持更低剂量给药,叠加GST-HG171优异的抗病毒药效,GST-HG171有望展现更好的治疗效果。
在临床前研究中,GST-HG171显示了优异的抗病毒药效和安全性。该3CL蛋白酶抑制剂对新冠病毒原始株、奥密克戎BA.4、BA.5变异株以及贝塔、德尔塔变异株均具有高效的病毒抑制活性,在新冠病毒动物模型上表现了优异的抗病毒药效,在K18-hACE2新冠真病毒小鼠模型上显示出高效的降低肺部病毒载量活性,在大鼠和犬GLP毒理实验中展现了良好的安全性。
三、募资逾9亿元,广生堂创新药研发提速在即!
广生堂1月6日晚公告,公司拟向不超过35名特定对象发行不超过4778.01万股(含本数)A股股票,拟募资总额不超过9.48亿元。按照预案,此次募集资金将主要用于公司的新冠药物研发及抗乙肝病毒药物研发项目,包括新冠口服小分子创新药GST-HG171(3CL蛋白酶抑制剂)、乙肝治疗的创新药GST-HG141、乙肝治疗的创新药GST-HG121临床研究等。
广生堂乙肝创新药研发管线
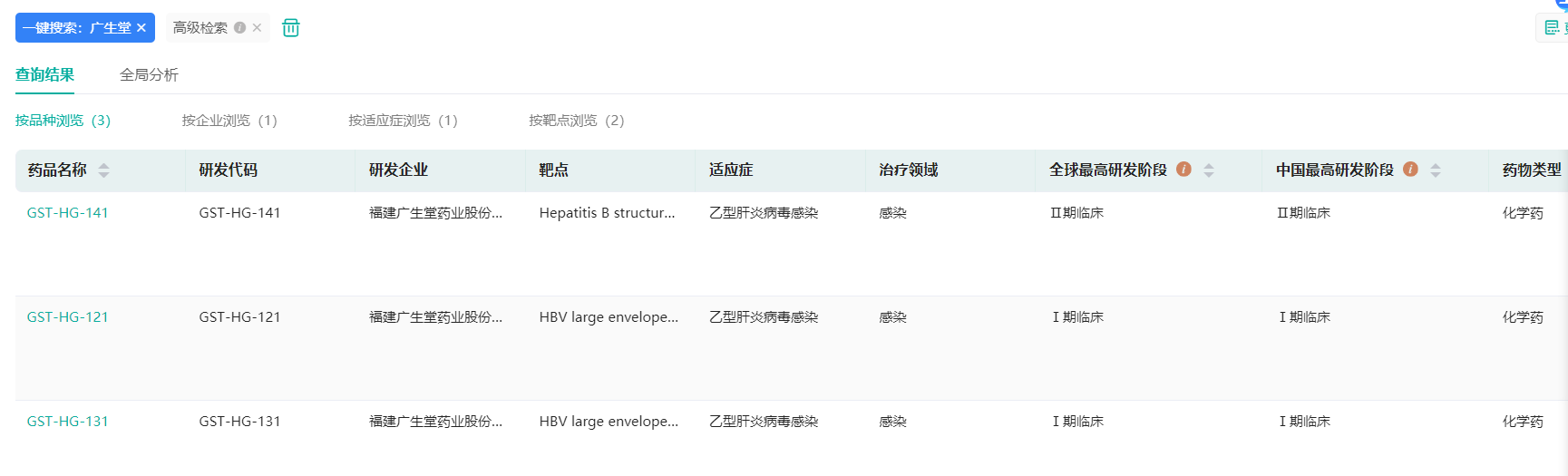
截图来源:药融云全球药物研发数据库
据介绍,GST-HG141是针对乙肝治疗的创新药,药物类型为核衣壳抑制剂。临床试验数据显示,该药物对于中国慢性乙肝患者具有良好的安全性和药效学、药代动力学特性。目前,GST-HG141已完成Ib期临床试验,试验结果积极,并已获得II期临床试验伦理委员会批件,正积极推进II期临床研究工作。
此外,GST-HG121也是针对乙肝治疗的创新药,药物类型为HBsAg抑制剂,是全新靶点的抗乙肝病毒一类新药,为全球First-in-class项目。综合临床前体外和体内实验数据,GST-HG121在药效实验中抑制HBsAg(乙肝表面抗原)效果明显。目前,GST-HG121药物正在开展I期临床试验,相关研发工作正在稳步推进中。

图片来源:PIXABAY
四、结语
广生堂作为一家积极转型的药企,目前正在逐步完成传统药企向新药创新企业的转变。公司旗下新冠口服小分子创新药和乙肝创新药都具有成为重磅药物的潜力,期待公司临床的积极进展,为国内患者带来更多性价比高的治疗选择。
参考资料:
1.广生堂公司官网,www.cosunter.com
2.药融云数据库,vip.pharnexcloud.com/?zmt-mhwz
2.东方财富网,http://quote.eastmoney.com/sz300436.html?&_t_t_t=0.5792320657055825
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

—END—






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论