
一、选择“什么样”的新药项目?
科技创新是“技术研发”到“成果转化”到“产业化”的复杂过程。
项目研发需要经费支持和产业化潜力,项目质量及可靠性需要高质量立项;需要高质量的早期遴选治疗靶点及其干预化合物筛选平台,以及药效学评价平台;投资主体需要真正了解早期医药研发项目的可靠性和转化潜力;创新医药发展需要“源头创新”药物,需要相关“转化支撑”机构。

选择“什么样”的新药项目?新药研发是一项长期、复杂、高风险、可预测性很差的巨大工程,选择适合公司自身战略发展的新药项目极为关键。公司应当考虑自身目前的实际情况、发展战略以及后续战略方向,全面分析技术数据,最终做出是否立项/引进的结论。
(1)目前的实际情况:资金实力、人员数量和素质、场地大小、仪器设备、现有项目和项目经验、管理制度等。
(2)发展战略/战略方向可能不断调整:首先明白真理:“世界上没有完美的新药项目”;直接对标大型药企还是先生存后发展(中大型制药企业的创新药项目布局一般是:平衡风险vs创新性,全方位布局,减少整体战略布局风险);选择专业化路线还是综合路线;在发展的过程中可能根据自身的发展情况不断调整发展战略,如:融资、强有力的技术专家的加盟、现有项目取得重大突破等。
(3)技术数据:根据现有数据按照新药研发、生产、销售的完整模块拼出整个“图像”技术数据解读应突出关键词:全面、显著的优势、显著的劣势、风险意识、市场导向、结合自身的战略方向扬长避短。
二、从哪些方面去评估拟立项/引进的新药项目?
1. 评估自研项目
从哪些方面去评估拟自主立项的新药项目?对于拟自主立项的项目,应从适应症、靶标、研究方案以及风险分析等四个方面进行评估。


(1)适应症
项目针对的适应症情况:综合考虑适应症的定义,症状和危害,病因,流行病学,分类,诊断以及目前的治疗手段等。
适应症目前的治疗药物:需考虑治疗药物的分类以及现有药物的优缺点,根据治疗指南和专家共识,从有利于医学和治疗的角度快速了解适应症药物的临床使用定位,对适应症现有药物进行综合评价。
(2)靶标
靶标的生物学情况:应当考虑靶标的组织分布,生物学结构(晶体结构),生物学功能以及靶标的种属差异。
靶标的成药性:需尤其关注尚未有任何药物上市的靶标,经大型药企临床试验失败的靶标,有迹象表明临床前数据与临床人体数据不一致的靶标,数据优异但仅有少数小公司介入的靶标,已研究多年但尚未有药物能突破II期临床的靶标。
靶标现有药物的综合评价:应当全面搜集并汇总该靶标目前上市/在研药物的所有数据,综合考虑这些药物的优缺点。
(3)研究方案
① 目标定位:尚未成药的靶标定位为first-in-class,已有药物上市但现有药物有缺陷明显定位为me-too → me-better → best-in-class,针对某种(类)特定药物的某种特定缺陷进行针对性改进。
② CMC研究:工艺开发、配方选择、工艺验证、分析方法开发和验证、产品放行和稳定性特点。
③ 早期药理评价(筛选)方案:按照传统顺序兼顾各个水平的药理模型(蛋白、细胞、动物水平),考虑特定靶标的特殊性,考虑项目的特殊要求,注意新药筛选模型需稳定可靠。
④ 项目开展的资源需求:综合考虑场地、设备、人员、经费、制度体系、特殊资质以及时间等
⑤ 项目开展的方案
(4)风险分析
四大风险:技术风险、资金风险、政策风险、市场风险
2. 评估引进项目
从哪些方面去评估拟引进的新药项目?对于拟引进的项目,主要考虑项目来源的公司、项目转让动机、项目是否涉及特殊药物、专利布局、销售情况、技术数据、是否与公司发展战略一致等八个方面。


(1)项目来源的公司:最佳的来源为国外(即将)上市的小型公司,项目刚上市/后期临床数据良好,但在中国的销售能力较差,同时需警惕某些小公司(可能是皮包公司)、某些中大型公司(可能存在技术风险)、纯学术研究机构
(2)项目转让/合作研究的动机:最佳的动机是国外中小公司在中国没有销售网络,寻求中国的合作伙伴;项目的流行病学中外有差异,如乙肝药物,同时需警惕项目有重大技术或者知识产权缺陷,项目转让方比较着急,毫无依据提高首付款比例等情况。
(3)项目是否涉及到特殊药物:强效药物、安全窗口很窄的药物等由于原料药和制剂的生产需要特殊的环境,成本较高;管制药物、毒性药物等由于研发、生产和流通全程需要监管,成本高且需要特殊的资质;辅助用药政策风险很大,特殊审批上市的药物往往具有某些技术优势,此外,还应注意目标人群的支付能力,患者对定价是否敏感等问题。
(4)项目的专利布局:需核对常规专利布局是否有缺陷,专利权是否牢固,有时即使某项专利获得授权,其专利权也不一定牢固(各国的专利审查标准不完全一样)。
(5)上市后销售情况/竞争对手销售情况:若拟引进项目已经上市,需研究上市后销售情况和市场占有率,分析其转让动机;若拟引进项目尚未上市,需研究同适应症和同靶标的药物的销售情况,了解未来的竞争环境。
(6)项目或者类似药物的流通情况:需研究拟引进的项目或者同适应症、同靶标的药物流动情况,如纳入基药目录和医保目录的可能性,进入OTC的可能性,招投标情况,是否会遭遇“集采悬崖”等等。
(7)技术数据:应当系统梳理和全面总结拟引进的药物的技术数据,与同类药物比较,查找优缺点,还应重点关注药物未来生产情况。
(8)是否与本公司现有的产品的销售渠道和发展战略相一致:应当检查拟引进的药物与本公司现有药物是否属于同一靶标、同一适应症或同一治疗领域,拟引进的药物是否符合公司未来重点布局的战略方向。
三、仿制药产品线设计需要考量哪些方面?
仿制药产品线设计需要考量哪些方面?仿制药产品线设计需考量:是否具有稀缺性、创新性(差异化)、与公司业务的协同性、延续性、前瞻性和技术可行性。


(1)稀缺性(准入门槛的相对高低)
原料药壁垒:冷门,无法买到;合成工艺复杂;工艺中易燃、易爆、高压、剧毒反应多。
制剂壁垒:研发难度大、投入大;特殊设备、特殊辅料。如吸入剂、渗透泵、透皮贴。
生产壁垒:定制化车间、定制化设备工艺、工艺复杂。如易氧化、易挥发的产品。
监管壁垒:申报一事一议,毒、麻、精、放。
(2)创新性(差异化)
技术创新:领先的载药技术平台,高壁垒或改良新药。
理念创新:特色小品种,电商机遇,如隐私性疾病,性病、ED、脱发、口臭、便秘、私密保养等。
(3)协同性(形成系列)
相同研发技术平台:如缓控释制剂、吸入制剂、透皮、预充注射剂。
相同销售管线:集采产品无须考虑该方面,非集采品种应考虑治疗领域的聚焦,OTC则应考虑品牌树。
相同生产线:因为MAH实施,该布局逻辑已经弱化。
(4)延续性(下一代产品是什么)
集采品种:不需销售投入,产品线的延续不用考虑。
专科药:建立强大临床专家资源,企业需要耗费大量成本,所以需要考虑升级和替代产品。
OTC:渠道建设需要花费多年时间和巨大推广广告费用,包括开发新剂型、新包装、新规格、新口感、新用药人群。
(5)前瞻性
由于研发和注册申报需要3-5年时间,需要对政策、经济、治疗趋势、疾病谱变化和消费习惯有预判,比如老龄化趋势、消费升级趋势(区分低中高差异化),要有做市场教育来拉动消费习惯的决心和勇气。
(6)技术可行性
不能局限在自己的研发能力上,需要考虑合作研发、授权引进、贴牌代工、战略收购等多种途径。
四、从哪些地方去获取这些信息?
从哪些地方去获取这些评估的信息?可以通过生物信息检索、化学结构检索、主题检索等。

生物信息检索:核酸(Genbank、RefSeq、GeneCards、Ensemble)、蛋白(UniProt、PDB、Proteinatlas、String、InterPro)、疾病基因组(TCGA、OMIM、CGD、ClinVar、Cosmic)、通路(Kegg、商业化数据库:Metacore(科睿唯安)、IPA(QIAGEN)、Pathway Studio(爱思唯尔)
化学结构检索:Scifinder、Reaxys 、STN等
主题检索:论文(知网、维普、万方,pubmed、cochrane、embase、scopus、web of science)、专利(中国国家知识产权局(CNIPA)、欧洲专利局(EPO)、美国专利局、STN)、临床试验(美国clinicaltrials、欧洲clinicaltrialsregister、中国临床试验登记平台)、药品监管和审批机构(美国FDA、欧洲EMA、日本PMDA、中国NMPA/CDE)、商业数据库(药融云、药渡、药智网、丁香园、PDB/CPM/RAS、米内网等)、制药公司官网
五、立项案例分析及高质量立项要点总结
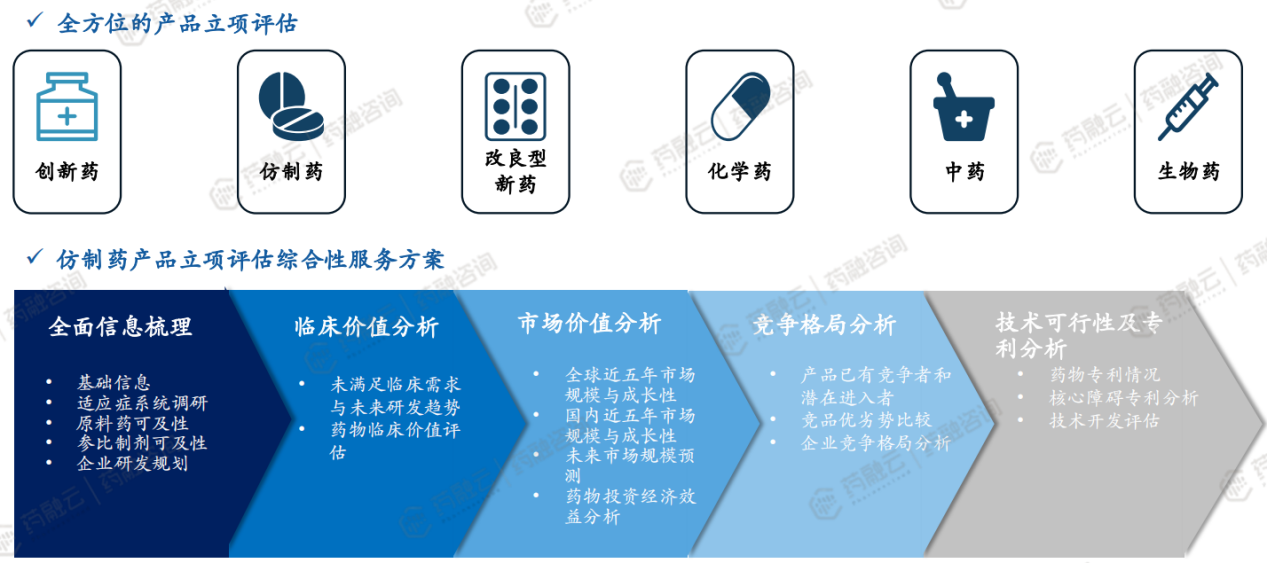
药融咨询产品立项评估综合性服务方案:全方位的产品立项评估、仿制药产品立项评估综合性服务方案(全面信息梳理、临床价值分析、市场价值分析、竞争格局分析、技术可行性及专利分析)
1. 案例分析
(1)创新药:筛选2023“中国新”靶点,帮助企业差异化布局

(2)创新药:2023“中国新”靶点TOP30及其治疗领域和临床阶段分布

(3)儿童药立项之运用医疗大数据和KOL访谈对整体市场规模及构成详细测算

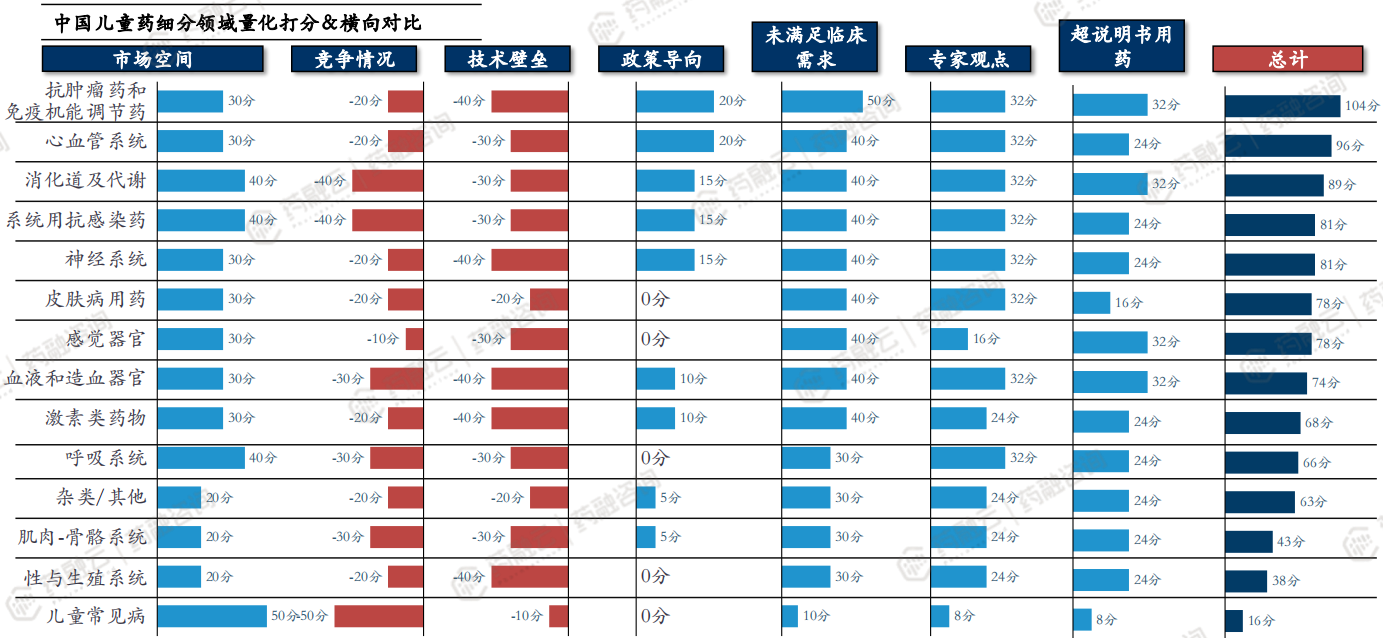
(4)儿童药立项之运用医疗大数据和KOL访谈对细分领域横向对比
(5)中国儿童药立项之定性访谈工具的运用

(6)仿制药:盐酸美金刚多奈哌齐缓释胶囊立项分析

(7)仿制药:盐酸美金刚多奈哌齐缓释胶囊立项分析——市场情况
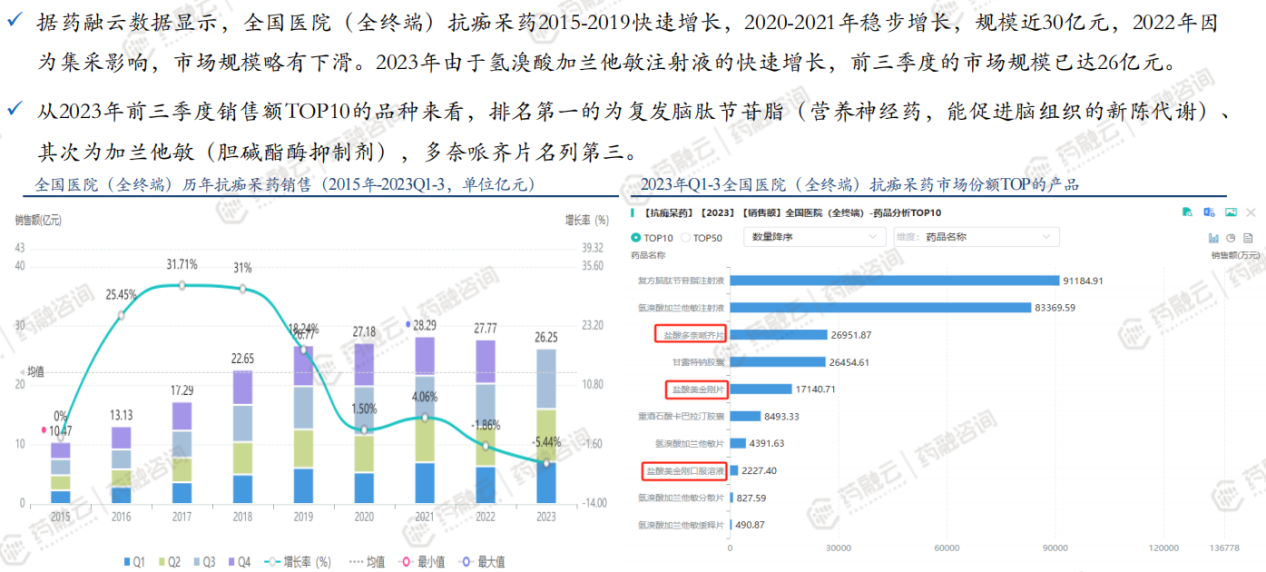
(8)仿制药:盐酸美金刚多奈哌齐缓释胶囊立项分析——市场情况

(9)仿制药:盐酸美金刚多奈哌齐缓释胶囊立项分析——集采情况

2. 既往案例示例
《**企业液体制剂产品调研报告》
《**混悬剂基于审评风险的立项可行性再评估报告》
《**脂质体立项评估报告》
《**疾病领域产品战略规划与仿制药立项》
《**药业成立MAH公司可行性研究》
《**外资企业儿童用药市场分析报告》
《**药业滴眼液市场分析报告》

3. 高质量立项重要Tips
(1)疾病的机制机理研究是否清晰或相对清晰是立项的前提;
(2)基于医疗大数据和临床KOL调研未满足的临床需求细节;
(3)从海量文献/专利数据中探索和关注新的方向和潜在机会;
(4)专利防护是决定成果转化价值的基础,是立项的重要内容之一;
(5)基于公开管线数据对现有的产品、靶点、适应症、企业进行统筹分析;
(6)关注现在正在进行的各类临床试验的积极/消极结果必不可少;
(7)需要有适合的(CXO)平台进行合作研究与代工生产可行性;
(8)关注相关交易、投融资热点;
(9)关注目前行业的局限(适应症局限,有效性安全性待提升,成本),也是未来的创新趋势,进行研发布局。
以上内容均来自药融咨询深度报告{以终为始 ,数据助力高质量立项},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论