
近日,FDA批准了首款NASH药物Rezdiffra(Resmetirom),用于与饮食和运动联合,治疗患有非肝硬化性非酒精性脂肪性肝炎(NASH)伴中度至晚期肝纤维化(F2至F3期)的成人患者。
在通往NASH成功之路上,不是所有药物都一帆风顺。有三款药物接近成功却最终失败,让人唏嘘不已。接下来小编带大家盘点一下这三款药物。
1. Obeticholic acid(奥贝胆酸)
Obeticholic acid(奥贝胆酸)是一款Farnesoid X receptor agonist(法尼醇X受体)激动剂药物,来自于美国公司Intercept Pharmaceuticals Inc,2016年首次在美国上市,可联合熊去氧胆酸用于对熊去氧胆酸反应不足的原发性胆汁性胆管炎(PBC)成人患者,或作为单药疗法用于对熊去氧胆酸不耐受的原发性胆汁性胆管炎(PBC)成人患者。
Obeticholic acid是NASH适应症领域第一个进入临床三期的药物,但是上市之路并未一帆风顺。2019年9月,Intercept递交NASH适应症上市申请,此次上市申请主要是基于III期REGENERATE研究的两次期中分析数据。2020年6月,FDA暂时拒绝了Obeticholic acid该适应症的上市申请并指出,根据FDA目前为止审查的数据,基于替代组织病理学终点的潜在益处仍不确定,没有充分证据能够支持Obeticholic acid被批准用于该适应症。FDA建议Intercept继续提交额外证据以证明其有效性和安全性,并且继续进行针对Obeticholic acid的长期研究。

图来自于Intercept Pharmaceuticals Inc官网
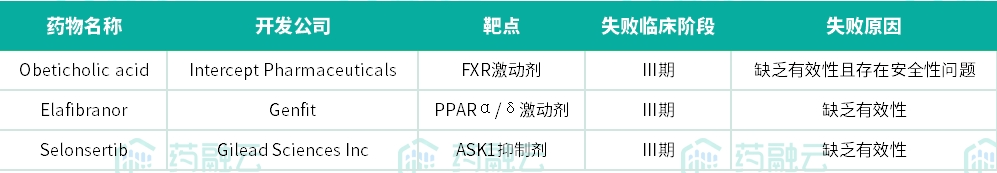
2022年7月,Intercept公布了REGENERATE研究中第一个主要终点的第二次期中分析数据。结果显示,接受Obeticholic acid(25mg,每日1次)治疗18个月时有22.4%的患者实现了纤维化程度至少改善1级且未出现NASH恶化,而安慰剂组达到该指标的患者只有9.6%(p<0.0001)。10mg Obeticholic acid组的数据与安慰剂组没有统计学差异。肝脏组织学的改善只是REGENERATE研究2个主要终点之一。
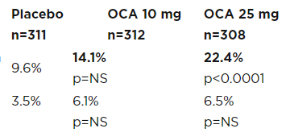
图来自于Intercept Pharmaceuticals Inc官网
2023年5月19日,FDA就Obeticholic acid召开了胃肠药物咨询委员会。专家就Obeticholic acid治疗NASH适应症进行了投票,结果为12人反对,2人支持,2人弃权。专家委员会认为,Obeticholic acid的临床试验使用了替代终点,而且Obeticholic acid还有引起药物性肝损伤的风险。因此,此次FDA在CRL中提出需要完成长期随访的成功临床数据。
2023年6月22日, Intercept决定停止NASH领域所有投资,重新聚焦到罕见病和感染性肝病领域。

图来自于Intercept Pharmaceuticals Inc官网
2. Elafibranor
Elafibranor是由法国公司Genfit开发的一款PPARα/δb为靶点的小分子激动剂。2014 年 2 月,FDA 批准 Elafibranor 用于治疗 NASH 的快速通道资格;2019 年 4 月,Elafibranor 被美国 FDA 认证为治疗原发性胆管炎(PBC)的突破性疗法。
2020年5月,GENFIT公布了Elafibranor治疗成人NASH临床三期试验(RESOLVE-IT)中期分析结果:Elafibranor对NASH消退的主要终点无显著的统计学影响。

图来自于Genfit官网
RESOLVE-IT III期试验评估了1070例经生物标志物证实的NASH患者(定义为NAS≥4,纤维化2期或3期)。患者按2:1随机分配,接受每日一次120mg Elafibranor或安慰剂。在第72周进行随访肝活检以评估组织学终点(NASH的缓解伴随无纤维化恶化或至少一个阶段的纤维化改善)。结果显示,接受Elafibranor治疗的人群NASH的缓解伴随无纤维化恶化比例(关键主要终点)为19.2%,安慰剂为14.7%,无统计学差异(p=0.0659)。
在关键的次要终点上,Elafibranor治疗组和安慰剂也没有显著差异,包括至少一个阶段的纤维化改善和代谢参数的变化(包括甘油三酯、非HDL胆固醇、HDL胆固醇、LDL胆固醇、非糖尿病患者的HOMA-IR和糖尿病患者的HbA1c)。
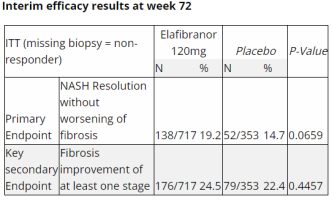
图来自于Genfit官网
目前,因试验未到临床主要终点,Genfit已经停止Elafibranor针对NASH适应证的临床试验,其治疗原发性胆汁性肝硬化(PBC)的临床开发仍在进行中。
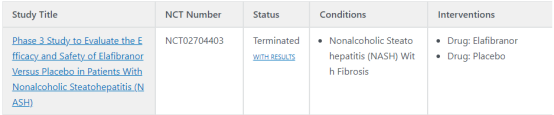
图来自于https://www.clinicaltrials.gov/
3. Selonsertib
Selonsertib是Gilead开发的一款ASK1抑制剂。2019年2月,吉利德宣布Selonsertib用于治疗NASH 所致的代偿性肝硬化(F4)患者的3期临床试验(STELLAR-4)未达到主要终点。随后2019年4月,吉利德又宣布Selonsertib在另一个3期临床试验(STELLAR-3)也未达到48周的主要终点。


图来自于Gilead官网
STELLAR-4中,在接受研究的877名入组患者中,14.4%(p=0.56)接受selonsertib 18 mg治疗的患者和12.5% (p= 1.00)接受selonsertib 6 mg治疗的患者在48周治疗后,实现大于等于1期纤维化改善且NASH无恶化,接受安慰剂的患者为12.8%,两个治疗组与安慰剂组相比均无统计学差异。

图来自于Gilead官网
STELLAR-3试验是一项临床3期试验,每日一次口服Selonsertib,用于治疗NASH 所致的纤维化(F3)患者。在接受研究药物的802名入组患者中,9.3%(p=0.42)接受selonsertib 18 mg治疗的患者和12.1% (p= 1.00)接受selonsertib 6 mg治疗的患者在48周治疗后,实现大于等于1期纤维化改善且NASH无恶化,接受安慰剂的患者为13.2%,两个治疗组与安慰剂组相比均无统计学差异。

图来自于Gilead官网
因为有效性缺乏的原因,目前这两项研究均已终止。
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论