
靶向蛋白降解(TPD)利用人体天然的泛素-蛋白酶体系统(UPP)来降解致病靶蛋白,自1999年被首次提出,其研究已进入第三个10年。不同于传统的小分子药物直接抑制或调控靶蛋白活性,TPD或将重新定义小分子药物的特征,有望为小分子药物带来新的黄金时代。

▲截图自药融云数据库
药融云数据库显示,Kymera Therapeutics(NASDAQ:KYMR)是一家临床阶段的生物制药公司,使用靶向蛋白质降解(TPD)技术发现和开发新的小分子药物,Kymera与药融圈此前发布的Arvinas均是TPD领域的龙头公司,但与Arvinas不同的是,Kymera重点布局了免疫/炎症领域。在靶点选择上,Kymera专注于已经经过临床验证,但关键生物节点/蛋白尚未实现成药或难以成药的疾病通路。Kymera曾入选2019年“生物技术猛公司”(FierceBiotech’s 2019 Fierce 15)。
研发进展

Kymera公司目前拥有靶向IRAK4、STAT3和MDM2的临床阶段项目,靶向STAT6和TYK2的临床前项目,以及早期开发阶段的多个项目,并在探索肿瘤学和免疫学之外的治疗靶点。
免疫学
1. IRAK4降解剂KT-474
Kymera公司的领头项目KT-474是一种高活性、选择性、口服生物可利用的潜在First-in-ClassIRAK4降解剂,用于治疗IL-1R/TLR驱动的免疫炎症适应症和存在高度未满足医疗需求的疾病,开发进度最快的适应症是化脓性汗腺炎(HS)和特应性皮炎(AD)。
该公司选择降解IRAK4(白细胞介素-1-受体相关激酶-4)是因为该靶点在IL-1R/TLR通路相关免疫和炎症中的作用得到了充分验证,且IRAK4是IL-1R/TLR信号通路中的一个关键节点,与多种不同炎症介质具有潜在关联,该信号通路同时依赖于IRAK4的激酶活性和支架功能。

Kymera通过体外和体内研究观察到KT-474诱导了IRAK4的降解,影响了激酶和支架功能,因此可以有效地选择性阻断IL-1R/TLR介导的炎症,并认为这一降解机制优于IRAK4激酶抑制剂,有望成为治疗多种炎症性疾病的最佳信号通路广谱口服抗炎药物。
KT-474入围了Drug Hunter 2023年度小分子榜单。据了解,KT-474是首个在肿瘤以外的临床试验中显示出活性的口服靶向蛋白质降解剂。

KT-474分子结构 图源:Drug Hunter
1期临床试验结果显示KT-474在化脓性汗腺炎(HS)和特应性皮炎(AD)患者中具有令人信服的数据和早期概念验证。
2020年7月,Kymera Therapeutics宣布与赛诺菲达成多项目战略合作,以开发和商业化针对免疫炎症性疾病患者的靶向IRAK4的First-in-Class蛋白质降解疗法,两家公司还将合作开展第二个早期阶段项目。Kymera将获得1.5亿美元的预付款,并可能获得超过20亿美元的潜在开发、监管和销售里程碑,以及大量的特许权使用费。此次合作官宣的次月,Kymera宣布完成1.998亿美元IPO。
目前,赛诺菲已将KT-474(赛诺菲研发代号SAR444656)推进了针对化脓性汗腺炎(HS)和特应性皮炎(AD)患者的两项2期临床试验,并在2023年第四季度分别完成了首例患者给药,分别为Kymera带来了4000万美元和1500万美元的里程碑付款。两项试验预计将在2024年完成入组,研究完成日期预计为2025年第一季度。

药融云数据库显示,国内公司领泰生物在研的LT-002是一款IRAK4降解剂,已在2023年分别获得中国国家药品监督管理局(NMPA)药品审评中心CDE和美国FDA批准开展临床I期试验,主要用于治疗化脓性汗腺炎(HS)和特异性皮炎(AD)。武汉朗来科技子公司美悦生物在研的MY004567片是一种IRAK4选择性抑制剂,于2021年6月18日获得国家药品监督管理局批准开展类风湿关节炎适应症临床试验。已完成的I期临床研究结果表明,MY004567片具有良好的安全性,健康成年志愿者空腹单次或每日一次连续14天口服本品的耐受性较好,同时食物对本品的体内吸收影响轻微,可支持一天一次、空腹或餐后给药。MY004567片II期临床研究正由上海交通大学医学院附属仁济医院牵头全国20家临床中心开展。另外,杭州多域生物也在开发本靶点候选分子。
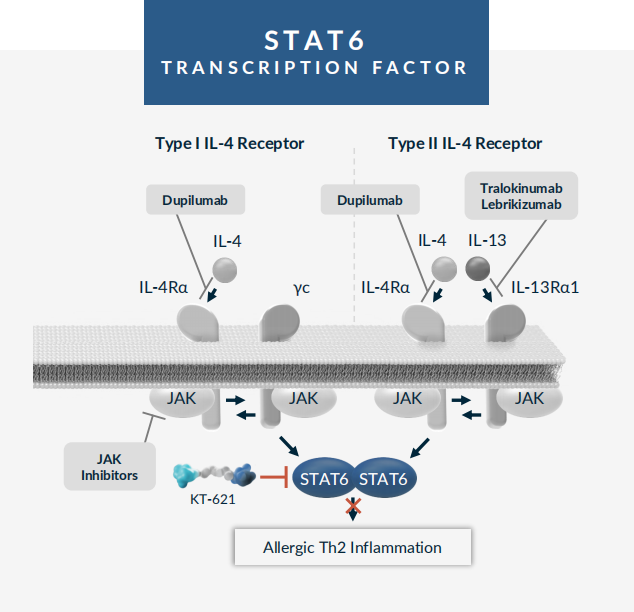
2. STAT6降解剂KT-621
KT-621是Kymera开发的一款潜在First-in-Class的口服STAT6降解剂,处于临床前研究阶段。STAT6是IL-4/IL-13信号通路的重要转录因子,也是过敏性疾病中2型炎症的中心驱动因素,包括特应性皮炎、结节性瘙痒症、哮喘、慢性阻塞性肺病、慢性鼻窦炎伴鼻息肉、嗜酸粒细胞性食管炎等。STAT6是一个经过基因验证的靶点,该途径已通过批准的IL-4/IL-13靶向生物制剂进行临床验证,如度普利尤单抗。Kymera认为,STAT6降解剂与靶向生物制剂相比,具有完全抑制该途径的潜力,且每日口服给药更加便利。临床前研究显示,KT-621在所研究的所有疾病相关的人类原代细胞类型中都显示出了皮摩尔效力的降解能力,且在人类细胞和动物模型中的临床前活性等于或优于靶向IL-4Rα的单克隆抗体度普利尤单抗,从而在许多皮肤病学、呼吸道和胃肠道过敏性疾病中显示出广泛的潜力。目前KT-621正在开展IND enabling研究,预计将在2024年下半年开展1期临床试验,并在2025年公布1期研究结果。
3. TYK2降解剂KT-294
KT-294是Kymera开发的一款潜在First-in-Class的口服TYK2降解剂,TYK2是JAK激酶家族的一个成员,它结合IL-12、IL-23和I型IFN受体,招募并使信号转导和激活转录(STAT)转录因子磷酸化。此外,TYK2具有成熟的支架功能,在细胞因子受体的表面表达和激活中发挥关键作用。TYK2的变构抑制剂(氘可来昔替尼)以及多种靶向IL-12、2IL-23和IFN-α的生物制剂已被批准用于多种自身免疫性疾病的治疗,因此TYK2是一个高度验证的靶点。不过,KT-294与氘可来昔替尼不同,并不抑制IL-10信号传导,IL-10在肠道内稳态中起重要作用,从而有望成为炎症性肠病、狼疮和牛皮癣等多种适应症的同类最佳药物。非人类灵长类动物研究显示,KT-294在低口服剂量下实现了TYK2的体内剂量依赖性的深度降解。目前KT-294正在开展IND enabling研究,预计将在2025年上半年开展1期临床试验,并在2025年公布1期研究结果。

肿瘤学
在肿瘤学领域,Kymera主要关注那些未成药或难以成药的靶点,但具有较大临床和商业影响的领域,重点关注可以同时治疗血液瘤和实体瘤的机制。
1. STAT3降解剂KT-333
KT-333是Kymera开发的一款潜在First-in-Class的STAT3降解剂,拟开发用于治疗血液系统恶性肿瘤和实体肿瘤,并同时在探索STAT3降解剂在自身免疫性疾病中的潜力。STAT3(信号转导和转录激活因子3)是一种难成药的转录因子,通过JAK途径或非JAK途径介导的多种不同的细胞因子和生长因子受体激活,也通过致癌融合蛋白和STAT3本身的突变激活。STAT3在肿瘤、逃避免疫监视和炎症/纤维化中发挥作用。目前尚无药物可在所有相关细胞类型中广泛地选择性阻断STAT3激活,或同时解决STAT3的磷酸化依赖和不依赖的功能。

1期临床研究中期数据显示,KT-333对STAT3的最大降解率高达96%;肿瘤中STAT3和pSTAT3阳性细胞分别减少了69%和87%;5例CTCL(皮肤T细胞淋巴瘤)患者中有3例(2例PR和1例SD),典型霍奇金淋巴瘤中1例PR的疾病控制,显示出单药活性;在实体肿瘤中,观察到4例头颈部肿瘤(H&N肿瘤)患者SD时间延长。在1期研究治疗后,一名CTCL患者的肿瘤活检诱导了干扰素γ标记预测抗PD-1治疗的敏感性,表明KT-333具有与PD-1抗体联合用药的潜力。Kymera预计KT-333将在2024年完成1a期剂量爬坡试验,并希望在2024年提供更多的临床数据。药融云数据www.pharnexcloud.com显示,美国FDA已授予KT-333用于治疗复发/难治性外周T细胞淋巴瘤的快速通道资格和孤儿药认定。

▲截图自药融云数据库
2. MDM2降解剂KT-253
KT-253是Kymera开发的一款潜在First-in-Class的MDM2降解剂,拟用于治疗实体肿瘤和血液系统恶性肿瘤。MDM2(双微体同源基因2)是最常见的肿瘤抑制因子p53的关键调控因子,在50%的野生型p53肿瘤中,MDM2的过表达和扩增可使p53失活。MDM2小分子抑制剂的活性受限于p53-MDM2反馈回路,干扰小分子抑制剂的药理作用。与小分子抑制剂不同,MDM2降解剂可去除该蛋白,克服p53依赖的反馈回路,上调MDM2的产生,从而产生急性凋亡反应。

在临床前研究中,KT-253已显示出能够克服MDM2反馈回路,并通过短暂暴露快速诱导癌细胞死亡,有望改善治疗并提供安全性。药融云数据www.pharnexcloud.com显示,KT-253于2023年6月被FDA授予用于治疗急性髓系白血病的孤儿药称号。KT-253的1期临床试验于2023年3月启动,该研究是一项开放标签剂量爬坡研究,旨在评估每三周静脉注射一次KT-253在复发或难治性高级别髓系恶性肿瘤、急性淋巴细胞白血病(ALL)、淋巴瘤和实体瘤成人患者中的安全性、耐受性、药代动力学/药效学和临床活性,并确定推荐的2期剂量。该公司在2023年11月获得了初始安全性、机制验证和概念验证数据,预计将在2024年提供更多的临床数据。Kymera还在开发一种基于生物标志物的患者分层策略,用于1a期之后的开发工作。
3. 已终止IRAKIMiD项目
2023年11月,Kymera宣布决定终止KT-413(IRAKIMiD)项目的开发。尽管KT-413达到了预期的降解水平且没有剂量限制毒性,但随着该公司对产品管线期望值的提高,弥漫性大B细胞淋巴瘤治疗前景不断变化,Kymera决定终止KT-413项目开发,以集中资源支持不断增长的免疫学管线。
专有技术
Kymera公司的名字灵感来自希腊神话中的一种狮首、羊身、蛇尾的神兽Chimera(奇美拉)。“奇美拉”在生物学中也用于描述工程化结合两种或多种成分的分子,即“嵌合体”。Kymera借此比喻了公司开发的异双功能小分子药物,使用两个不同的“末端”与两种不同的蛋白质结合,并选择性地将负责蛋白质降解的细胞机制定位到致病蛋白质。
Kymera专有的TPD技术平台叫做Pegasus(希腊神话中的“天马”)帮助发现高选择性的、具有全身抗致病蛋白活性的小分子靶向蛋白质降解药物。截至目前,Kymera已经借助Pegasus平台开发了免疫-炎症和肿瘤领域的新型蛋白降解剂,并将继续拓展其他治疗领域。
Pegasus平台技术基于该公司对E3泛素连接酶和靶蛋白之间关系的理解,从而识别出那些针对既可连接又可降解的靶点的资产,并确定多种因素对药物效价、选择性、药代动力学(PK)和药效学(PD)的影响。

开发靶向蛋白降解药物涉及三元复合物(E3连接酶、降解剂分子和待降解分子)的设计和优化以及各组分之间的相互作用。Kymera已经创建了一个集成方法的工具箱,以加速降解药物的发现和开发,能够研究分子结构并全面了解蛋白质的生物学机制,包括:
- 全面的苗头化合物识别策略,使用高内涵和符合目标的技术,例如DNA编码库、片段和X射线筛选。
- 利用机器学习和人工智能进行苗头化合物验证,以及优化技术。
- 结构(例如X射线晶体衍射、低温电子显微镜)和以药代动力学/药效学为中心的先导化合物优化。
- 专注于患者疾病样本的先进转化生物学。
此外,该公司利用蛋白质组学定量技术将靶蛋白与来自不同组织和细胞类型的600多种独特选项库中的最佳E3连接酶相匹配,从而最大限度地提高每个分子的功效。
Kymera的目标是利用TPD方面的领先能力,成为一家完全集成的生物制药公司,拥有一个新型蛋白质降解药物管线。该公司打算通过实施以下战略来实现这一目标:推进现有临床管线;建立一个广泛和多样化的新型蛋白质降解剂的管线;扩大和保护专有能力和知识产权;寻求协同合作机会;在组织中建立能力,包括在关键治疗领域和功能方面的专业知识。
财务状况
2023全年,Kymera公司总合作收入为7860万美元,包括来自Vertex的840万美元和来自赛诺菲的7020万美元。(Kymera曾在2019年与Vertex达成为期4年的研发合作)而2022年合作收入为4680万美元。2023全年研发费用为1.891亿美元,一般及行政开支为5500万美元。

下表为Kymera各项目研发费用情况:

2024年1月9日,Kymera宣布完成2.75亿美元的公开募股。截至2024年1月9日,Kymera拥有约7.45亿美元的现金、现金等价物和投资资产,预计将现金跑道延长至2027年上半年。除了支持现有临床项目之外,Kymera还将继续寻找加速增长和扩大其产品线、技术和临床适应症的机会。截至2024年5月,Kymera Therapeutics市值约21.53亿美元。


▲截图自companiesmarketcap
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论