一、致命毒素变美容秘方
肉毒杆菌毒素俗称肉毒素,是由肉毒杆菌产生的一种细菌外毒素,具有较强的神经阻滞作用,其本质是通过与神经末梢突触前膜上的特异性受体结合,影响突触囊泡与突触前膜融合,阻滞乙酰胆碱等神经递质的释放,引起肌肉松弛、腺体分泌障碍等化学性去神经作用。
自1989年美国FDA批准世界上首款用于临床治疗的肉毒素——Onabotulinum toxin A上市以来,肉毒素作为一种重要的神经调节剂,已在全球应用于多种医疗美容适应症,以及神经、康复及泌尿等临床治疗领域。
根据DRG的数据,2022年全球神经调节剂市场规模约为63亿美元,而2021年为57亿美元,预计到2027年将达到92亿美元左右,2022年至2027年的复合年增长率约为7.8%。据估计,2022年神经调节剂在美容适应症和治疗适应症的市场规模分别约为53%和47%。随着人口结构、生活方式的变化、新适应症以及在新地区推出产品将推动神经调节剂市场持续增长。
二、重磅长效肉毒素获批,只需一年两针
2022年9月,专注于创新美容和治疗产品的生物技术公司Revance Therapeutics宣布美国FDA已批准其重磅长效肉毒素注射剂DAXXIFY™(DaxibotulinumtoxinA-lanm)用于暂时改善成人中度至重度眉间纹。
截图来源:药融云美国紫皮书数据库
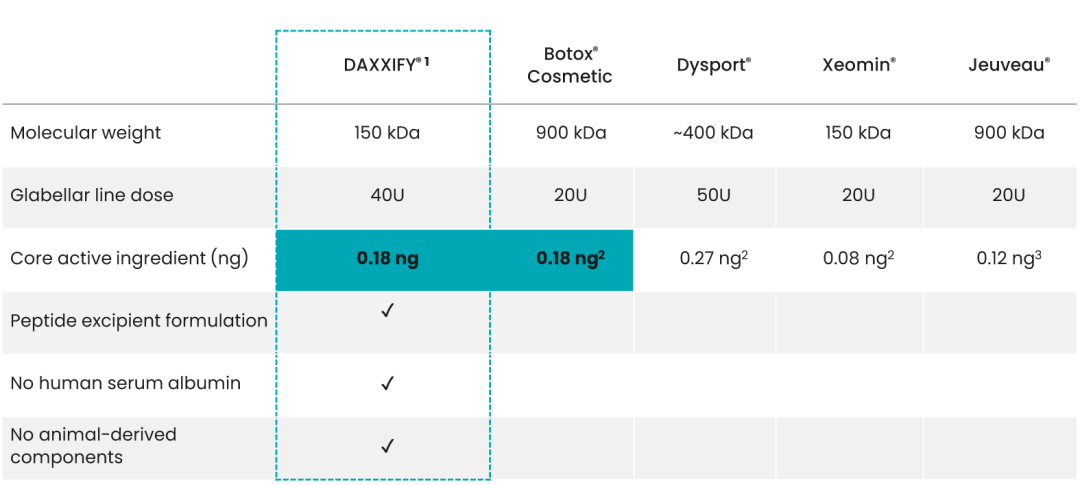
DAXXIFY™是首款也是目前唯一一款使用Revance公司专有的肽交换技术™(Peptide Exchange Technology,PXT)稳定的神经调节剂,不含人血清白蛋白和动物性成分。
3期临床试验显示,DAXXIFY™治疗患者的中位持续时间长达6个月,在部分患者中甚至维持了9个月的效果。对于使用神经调节剂的消费者和注射操作人员来说,肉毒素产品的疗效维持时间是最大的未满足需求之一,DAXXIFY™只需每年的两次注射即可实现全年效果,而传统的神经调节剂则需要每3~4个月注射一次。
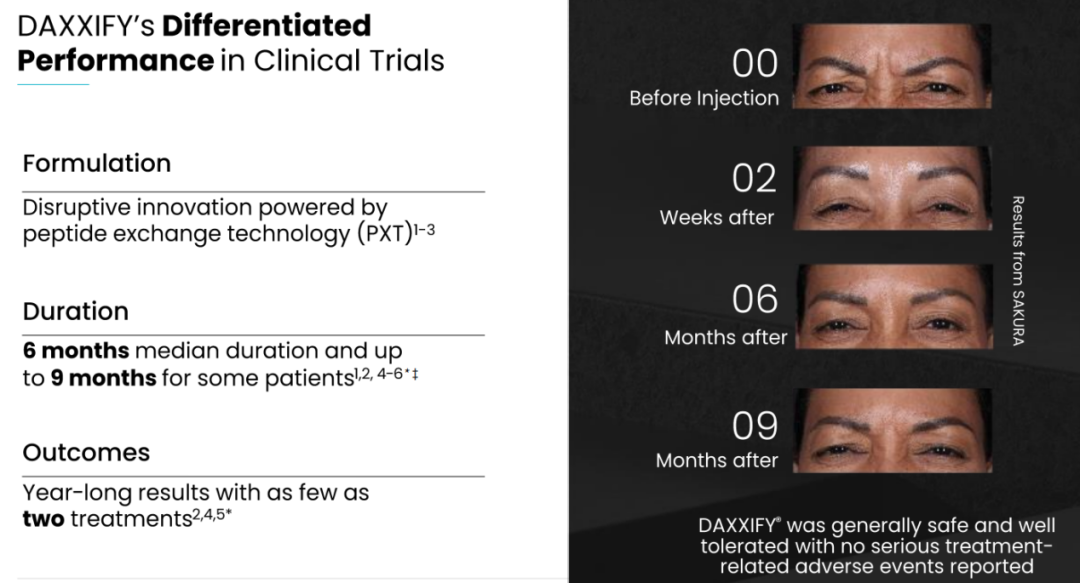
DAXXIFY™(DaxibotulinumtoxinA-lanm)的创新点在于使用了Revance Therapeutics专利的由35个氨基酸合成的稳定肽赋形剂,带有高密度正电荷,与带有负电荷的核心神经毒素通过静电作用相结合,可防止A型肉毒素(BONT/A)的吸附与聚集、增强与细胞膜的亲和力、增强肉毒素向目标部位的输送,并有可能增强毒素内转。

药融圈旗下药融云数据www.pharnexcloud.com/?mh显示,目前全球市场上主要的肉毒素产品包括艾尔建的Botox(OnabotulinumtoxinA,保妥适)、英国IPSEN公司的Dysport(abobotulinumtoxinA,吉适)、德国Merz公司的Xeomin(incobotulinumtoxinA),以及Evolus公司的Jeuveau(prabotulinumtoxinA)等。DAXXIFY(DaxibotulinumtoxinA-lanm)的获批使得Revance Therapeutics将在全球肉毒素市场与这些企业进行直接竞争。
截止2023年6月2日收盘,公司市值约26亿美元,每股价格31.06美元。

三、曾遭艾尔建诉讼,复星引进国内
早在2019年11月,Revance Therapeutics便宣布已向美国FDA提交了DaxibotulinumtoxinA注射剂治疗眉间纹的BLA申请,按照原计划,DAXXIFY(DaxibotulinumtoxinA-lanm)本应在2020年底获批,但因COVID-19影响,限制了FDA的现场检查,从而推迟了审查决定。
2021年10月初,就在FDA再次做出审查决定之际,主要竞争对手艾伯维子公司艾尔建起诉Revance,指控其DaxibotulinumtoxinA注射剂侵犯了艾尔建肉毒素的数项专利,寻求法院判决Revance侵权,并要求赔偿损失,包括“合理的专利使用费和利润损失”。而Revance则认为公司以及供应合作伙伴Ajinomoto(味之素)并未侵犯艾尔建的专利,专利本身或是无效的,并表示此次诉讼是艾尔建试图分散竞争对手注意力的常见策略,也足以说明艾尔建对Revance即将获批的差异化产品对其市场影响的担忧。
一波未平一波又起,2021年10月15日,Revance Therapeutics宣布美国FDA已发布了关于注射用DaxibotulinumtoxinA用于治疗中度至重度眉间纹的BLA申请的完整回复函,FDA已确定无法批准当前的BLA申请,并表示在Revance生产工厂的现场检查中发现缺陷。
受到这两个利空消息影响,Revance Therapeutics当月股价暴跌,总市值从2021年10月初的20亿美元跌至10月底的不到10亿美元。不过在2021年12月,Revance召开了A类会议,随后应FDA要求完成了三个连续原料药批次和一个制剂批次的生产,以解决与WCB(工作细胞库)和原料药生产工艺有关的缺陷问题。2022年3月,Revance宣布已重新向FDA提交DaxibotulinumtoxinA注射剂治疗眉间纹的BLA申请。2022年9月,DAXXIFY™(DaxibotulinumtoxinA-lanm)获批之时,Revance Therapeutics市值重回20亿美元。
Revance股价变化(2021年10月至2023年5月)
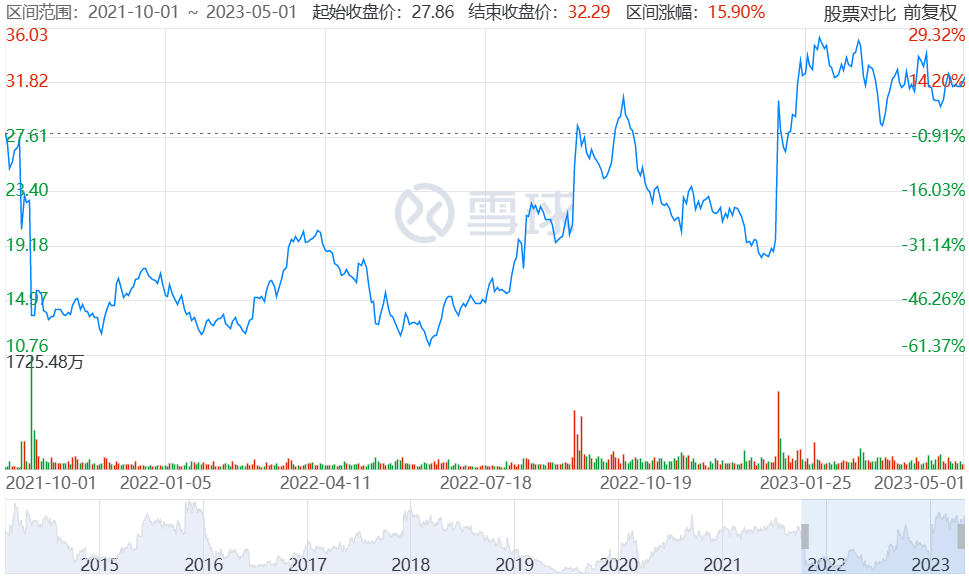
截图自雪球
2022年10月,Revance向美国FDA提交DAXXIFY™(DaxibotulumtoxinA-lanm)用于注射治疗颈部肌张力障碍的补充生物制品许可申请(sBLA),该申请在2023年1月获FDA受理,PDUFA日期在2023年8月19日。
在国内,DAXXIFY™(Daxibotuli numtoxinA-lanm)由复星医药引进。2018年12月,复星医药控股子公司复星医药产业与Revance Therapeutics签署许可协议,获得RT002(即Daxibotulinumtoxin A型肉毒杆菌毒素)在中国大陆、香港及澳门地区的独家使用、进口、销售及其他商业化(不包括制造)权利许可。根据该协议,复星医药产业应向后者支付至多8800万美元的许可费用以及至多1.725亿美元的销售里程碑款项。
药融圈旗下药融云数据库显示,2023年4月,RT002(即Daxibotulinumtoxin A型肉毒杆菌毒素)用于暂时性改善成人因皱眉肌/或降眉间肌活动引起的中度至重度皱眉纹的药品注册申请已获国家药品监督管理局审评受理。
Daxibotulinumtoxin A适应症研发现状(登录“药融云数据库www.pharnexcloud.com/?mh”可查看更多内容)
截图来源:药融云全球药物研发数据库
四、“无心插柳”,意外发现的重磅产品
Revance Therapeutics一开始以Essentia Biosystems为名,于1999年8月在美国特拉华州注册成立,2002年在硅谷开始运营。最初公司致力于探索在疾病诊疗中,多肽对于大分子递送的潜在用途,如免疫调节剂、胰岛素和肉毒杆菌毒素,尤其是新型肉毒素的开发。2005年4月,公司更名为Revance Therapeutics,此举由当时的董事会成员Rowland Hanson推动(比尔·盖茨的早期雇员,微软Windows便是他命名)。

Revance公司当时首要开发产品是涂抹型外用A型肉毒素凝胶RT001,该产品采用了公司专有的TransMTS®载体肽递送技术,以专利肽RTP004携带肉毒素至真皮中层并释放。Revance当时还与医疗设备供应商Duoject Medical Systems合作,为RT001设计了专有的一次性给药装置。2007年,Revance Therapeutics启动RT001用于外眦纹(即鱼尾纹)的临床试验,在2008年启动了针对腋窝多汗症的临床试验。Revance涂抹型肉毒素的概念一经提出便获热捧,2014年公司成功登陆纳斯达克(NASDAQ:RVNC)。
然而RT001后续的临床试验结果并不如预期。2016年,Revance宣布RT001治疗中重度鱼尾纹的3期临床试验未达到其共同主要终点和其他终点,因此不再继续开发鱼尾纹适应症,腋窝多汗症的临床开发计划也一并终止。公司的开发重点转向了第二款候选产品——长效注射肉毒素RT002(Daxibotuli numtoxinA),也即后来的DAXXIFY™(DaxibotulinumtoxinA-lanm)。
RT002的发现颇有“无心插柳”的意味。Revance Therapeutics科学顾问委员会成员Ellen Marmur博士曾在一次采访中透露,在开发外用涂抹型肉毒素时,FDA要求将这种新分子与当前的金标准,即注射用A型肉毒素进行比较,然而团队意外发现,公司开发的注射用肉毒素比传统的肉毒素更为长效。
2012年,Revance在墨西哥完成了RT002(DaxibotulinumtoxinA)的首例人体试验,2014年先后启动了DaxibotulinumtoxinA治疗眉间纹、颈部肌张力障碍和足底筋膜炎的临床试验。2017年,Revance宣布DaxibotulinumtoxinA(RT002)在关键3期SAKURA试验中达到主要终点和所有次要终点,实现了长达6个月的持续疗效。
五、主要产品与开发计划
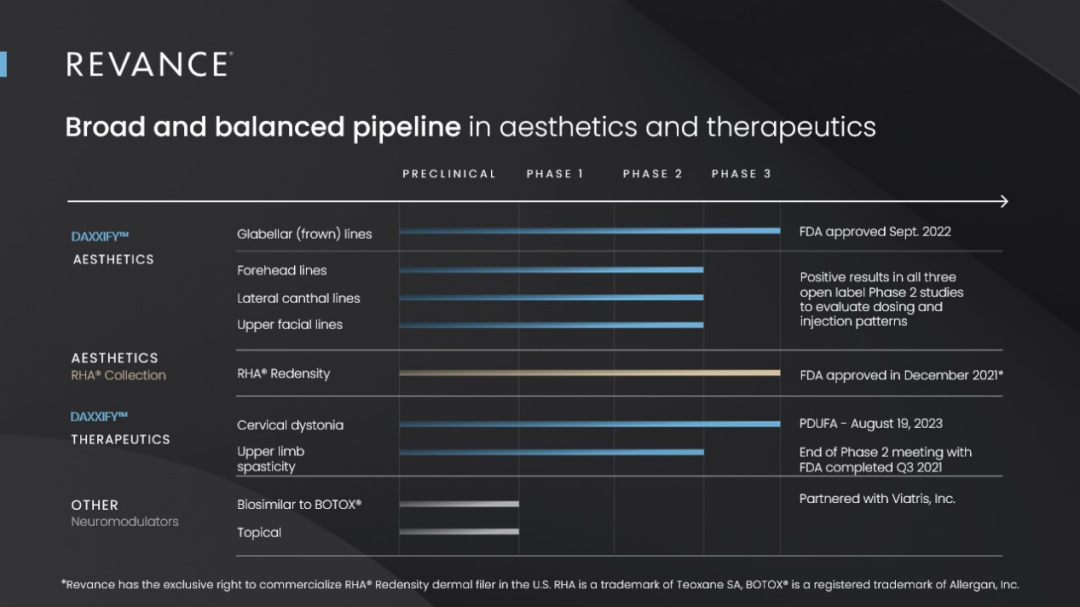
当前Revance Therapeutics的目标是成为多种美容和治疗适应症的肉毒素产品领先供应商,通过创新的产品和服务,为医美行业树立新的标准。除了DAXXIF(DaxibotulinumtoxinA-lanm),公司当前主要产品和服务还包括RHA透明质酸填充剂系列产品,关系商务平台OPUL。

对于肉毒素产品DAXXIFY™(DaxibotulinumtoxinA-lanm),除了用于治疗眉间纹和颈部肌张力障碍,公司正从美容和治疗两个方向拓展其适应症。针对上面部皱纹(UFL),Revance已在2020年12月完成了一项多中心、开放标签的2期临床试验,以测试其安全性和有效性,包括潜在的剂量和注射模式;针对额头纹,公司已在2020年6月完成了一项2期多中心、开放标签、剂量递增研究,以评估联合治疗眉间纹和中度或重度动态额头纹的效果;针对外眦纹(LCL,即鱼尾纹),公司已在2020年6月完成了一项2期多中心、开放标签、剂量递增研究,以评估药物在外眦区的潜在剂量。在治疗适应症领域,针对足底筋膜炎,基于2期研究的结果(主要疗效终点未达到),该公司不再寻求DAXXIFY™对于该适应症的批准,而是针对上肢痉挛和偏头痛进行开发。针对上肢痉挛,公司在2021年10月与美国FDA举行了2期临床结束会议,为3期临床试验设计提供了依据;针对偏头痛的临床试验启动时间正在评估中。
在肉毒素领域,药融圈旗下药融云数据显示,Revance Therapeutics在2018年2月与仿制药巨头Mylan(现为Viatris)达成战略合作,共同开发与商业化Botox(OnabotulinumtoxinA,保妥适)的生物类似药产品。2019年2月,Revance与FDA和Viatris就一个拟议的onabotulinumtoxinA生物类似药候选产品进行了生物类似药初始咨询会议,基于FDA的反馈,Revance和Viatris认为采用351(k)途径开发onabotulinumtoxinA生物类似物是可行的,目前公司正在推进该生物类似药项目,并将向FDA递交IND申请。

截图来源:药融云全球医药交易数据库
而对于涂抹型外用肉毒素,虽然先前已经有所尝试,但Revance表示未来依然可能会对外用候选产品开展额外的临床前研究工作。
RHA®透明质酸填充剂系列产品来自于Revance Therapeutics与瑞士著名皮肤填充剂研发商Teoxane公司在2020年初签订的进口、营销、推广、销售和分销协议,授予Revance该系列产品在美国的专营权。RHA®是唯一被FDA批准的透明质酸(HA)填充剂,用于中度至重度的动态面部线条、皱纹和褶皱,如鼻唇沟(RHA 2、RHA 3、RHA 4/2020年9月推出)和口周皱纹(RHA®Redensity/2021年12月获批,2022年7月推出)。相较于传统的透明质酸填充剂,RHA®系列产品更加接近天然的透明质酸结构,RHA保持网格技术产生一种刚性较低的交联凝胶结构,以适应面部动态而不影响其耐久性。
Revance产品管线概览(更新至2023年3月)
OPUL®是首款面向美容垂直领域的关系商务平台,旨在改变现有的支付处理生态系统,改善美学金融和患者体验。该系统始于2020年7月Revance Therapeutics对HintMD的收购,获其独特的集成数字服务平台和美国美容实践支付服务。2021年11月,OPUL®关系商务平台推出并逐渐取代HintMD平台。OPUL®平台包含POS、软件和硬件终端,可提供无缝和智能支付、实践报告和见解以及可定制的结账选项。
六、主要财务状况
2022全年,Revance Therapeutics总收入1.326亿美元,同比增长70%。其中,在第四季度,Revance公司开启了肉毒素产品DAXXIFY™(DaxibotulinumtoxinA-lanm)的PrevU早期体验计划,并实现了1100万美元的业绩,该产品在2023年3月正式商业化推出,前景可期;RHA®透明质酸填充剂系列产品全年业绩为1.072亿美元,同比增长51%,这两个产品线将是公司主要增长动力。此外,Revance全年对外合作收入为744.4万美元(+32%),主要来自于公司和Viatris的生物类似药合作;服务收入为699万美元(+428%)。
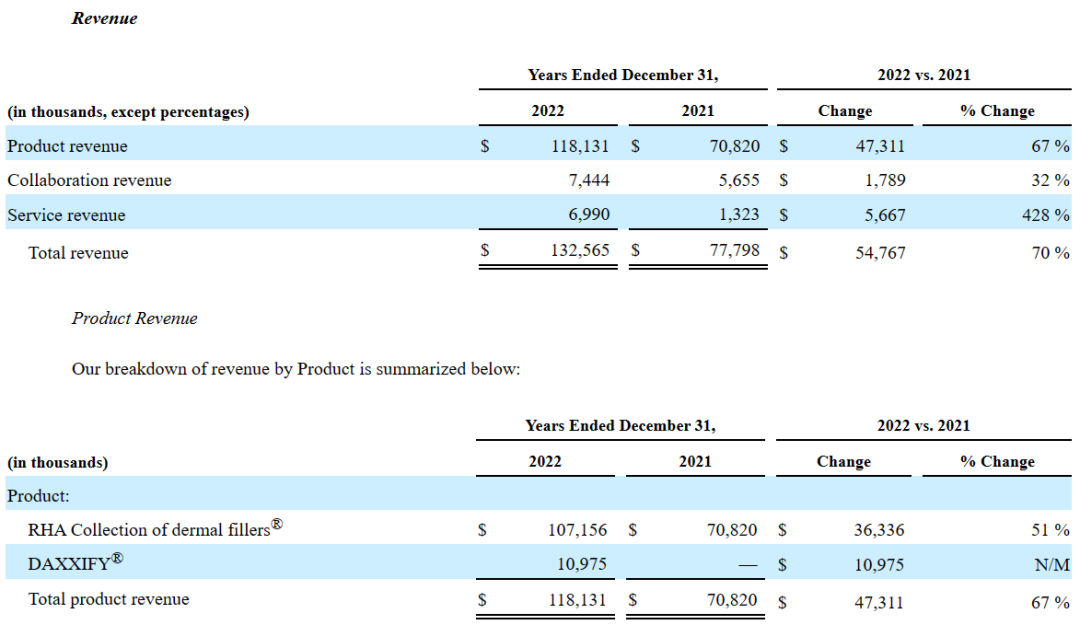
2022全年,公司总运营成本为4.745亿美元,同比增长35%,其中产品收入成本为4441.4万美元,服务收入成本为725.3万美元,全年一般及行政支出为2.239亿美元,研发费用为1.013亿美元。
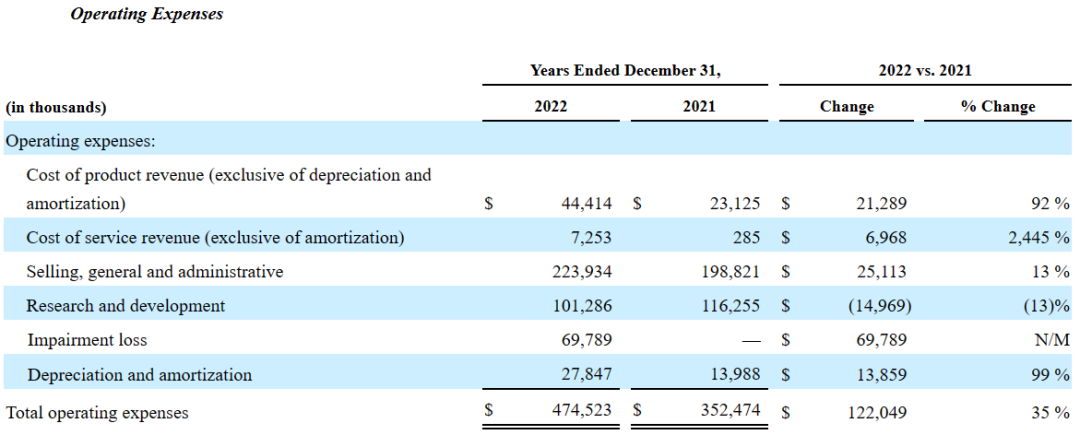
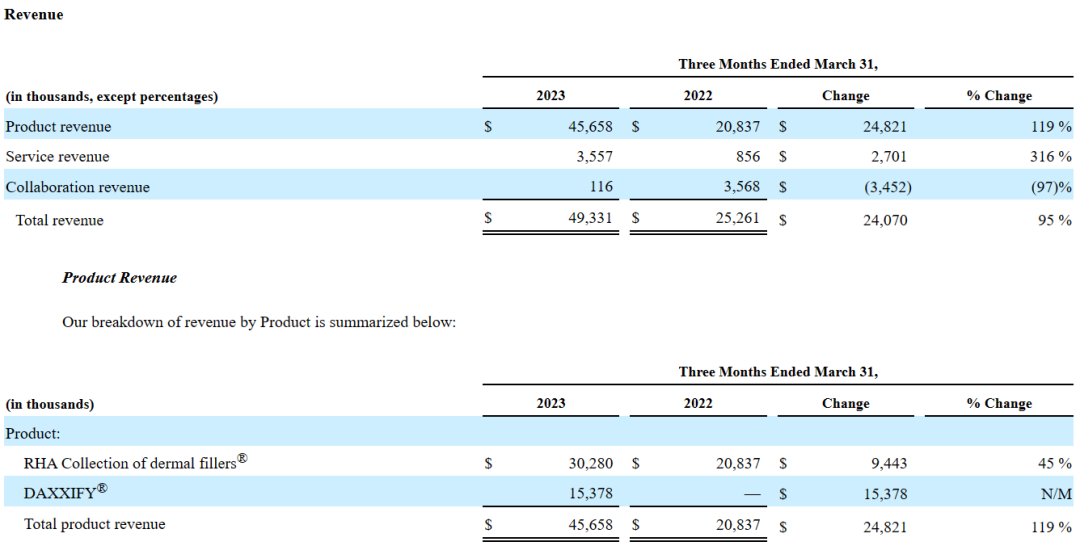
2023年第一季度,Revance Therapeutics总收入4933.1万美元,同比增长95.3%。主要得益于RHA透明质酸填充剂系列产品(3028万美元,+45%)和肉毒素产品DAXXIFY(DaxibotulinumtoxinA-lanm)(1537.8万美元)的业绩增长;第一季度服务收入为355.7万美元(+316%);对外合作收入为11.6万美元。
2023年3月,FDA批准味之素生物制药服务(Aji)的批准后变更(PAS)申请,Aji是Revance医美填充产品的合同制造商,获得批准之后Aji将支持DAXXIFY™(DaxibotulinumtoxinA-lanm)的商业增长,在此之前,Aji生产的所有库存产品均已用于商业用途。
截至2023年3月底,Revance公司拥有现金、现金等价物和短期投资共2.739亿美元。结合预期的运营支出以及收入预估,管理层预计公司的医美产品组合(DAXXIFY®、RHA®系列产品、OPUL®)在2023年或可实现现金流盈亏平衡。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库vip.pharnexcloud.com/?mh;
FDA/EMA/PMDA;
相关公司公开披露(正文图片均来自企业官方,除非另有说明);
中国肉毒毒素治疗应用专家共识[J].中华神经科杂志, 2018, 51(10):8.;
https://investors.revance.com/news-releases/news-release-details/revance-announces-fda-approval-daxxifytm-daxibotulinumtoxina;
修美乐“专利悬崖”到来之际,Abbvie加紧布局“银发经济”“女性经济”等;
https://investors.revance.com/news-releases/news-release-details/revance-reports-results-rt001-topical-phase-3-trial-lateral;
https://pubmed.ncbi.nlm.nih.gov/31791824/;
https://www.fiercepharma.com/pharma/as-Revance-nears-a-potential-launch-for-its-botox-competitor-abbvie-sues-to-stop-it;
https://www.popsugar.com/beauty/daxxify-48944954;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论