一、ADC药物持续火热
2023年3月,当辉瑞宣布将以每股229美元、共计430亿美元的价格,收购ADC龙头企业Seagen之时,就已引爆ADC领域全球重磅交易这一把火。
2023年5月3日,美国生物技术公司ImmunoGen对外宣布用于治疗卵巢癌的全球首创(first-in-class)ADC药物ELAHERE®在Ⅲ期临床MIRASOL试验中获得了积极的关键数据,于FRα阳性铂类药卵巢癌患者中证明了总体生存获益。该消息让ImmunoGen股价当天大涨136%,市值达到27.7亿美元。截止2023年5月30日美股收盘,公司市值约33.9亿美元。

药融云数据库显示:Mirvetuximab soravtansine是华东医药子公司中美华东制药与ImmunoGen合作开发的,用于治疗铂耐药卵巢癌的全球首创ADC药物,相关专利为WO-2011106528。
Mirvetuximab soravtansine药物研发信息(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)

截图来源:药融云全球药物研发数据库
看似突如其来,但其实从2021年下半年开始,ADC领域就开始大肆吸金,重磅玩家强势入局,多起高额交易层出不穷。目前,ADC药物赛道一片繁荣,已成为医药行业公认的“下一个PD-1”。ADC市场潜力巨大,近几年交易数量、首付款及总金额均呈直线上升趋势。我国ADC企业同样表现亮眼。

药融圈生物药大时代整理
目前全球共有400余个ADC在研药物,其中进入临床阶段的超过200个。全球已上市ADC药物15款,FDA已批准13款,据弗若斯特沙利文的预测,2030年全球ADC药物市场有望达到638亿美元。
部分ADC药物业绩
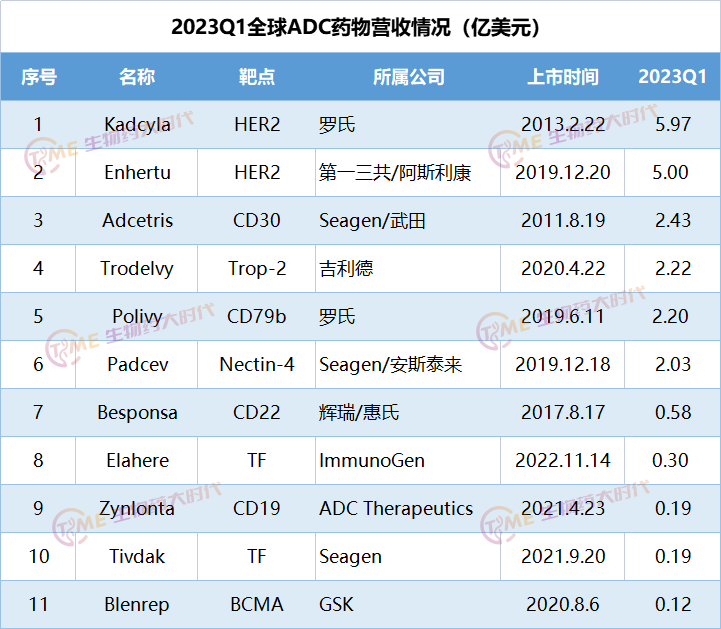
药融圈生物药大时代整理
二、ADC:“魔法子弹”的创新之路
Paul Ehrlich于1913年首次提出“魔法子弹”的概念,基于此,1958年首款抗体-细胞毒偶联药物问世,将抗体与甲氨蝶呤偶联用于治疗白血病,但并未成功。1970年代杂交瘤技术的出现使ADC研发步入正轨,ADC药物首次进入动物实验。
在第一代ADC药物中,丝裂霉素C、长春花生物碱等抗肿瘤药物主要通过不可裂解的连接物(酰胺或琥珀酰亚胺)与鼠单抗偶联,存在较严重的免疫原性问题。继80年代末Greg Winter开创人源化单克隆抗体技术,2000年Mylotarg成为首款获批的ADC药物,但Ⅲ期研究发现其无更显著的临床优势,且具有严重的肝毒性,2010年主动撤出市场;在辉瑞调整过给药方案后,2017年被FDA重新批准上市。
第二代ADC药物代表为2011年上市的Adcetris(Seattle Genetics)和2013年上市的Kadcyla(罗氏),使用了以曲妥珠单抗为代表的人源化单抗以及更高效的小分子药物,共同驱动ADC技术的升级迭代。
但偶联方式仍与第一代类似,linker的稳定性仍待提高。此外由于脱靶毒性、存在未结合抗体以及药物抗体比(DAR)较大引起ADC聚集或快速清除,目前大多数第二代ADC显示出较窄的治疗窗口,难以满足患者的需求。
研究永无止境,很快第三代ADC药物进入人们的视野。其利用小分子药物与单克隆抗体的位点特异性结合,可确保具有明确DAR的抗体偶联药物;另外抗体、连接物、结合小分子药物的优化,使药物活性、稳定性和药代动力学大大提高,药物毒性和偶联脱落速度更低,低抗原水平下的细胞活性高。仅2019年以来就上市了8款药物,将治疗适应症扩增到膀胱癌和胃癌。
全球目前已上市的ADC药物的治疗领域主要集中在血液瘤和实体瘤方面,并且主要用于患者的后线治疗,包括晚期、复发/难治性以及转移性的肿瘤适应症,在未来几年里预计继续成为抗癌领域的研究热点。

在2022年,FDA仅批准了1款ADC药物,即ELAHERE®(Mirvetuximab soravtansine-gynx)。该药是华东医药股份有限公司全资子公司杭州中美华东制药有限公司美国合作方ImmunoGen开发的,用于治疗铂耐药卵巢癌的全球首创ADC药物。今天要介绍的主角即是ImmunoGen,这是一家大有来头且历史悠久的ADC药物龙头公司。

ImmunoGen Inc.是一家来自美国的临床阶段生物技术公司,成立于1981年,专注于开发基于抗体的抗癌疗法,是抗体偶联药物(ADC)技术的领先者,最早布局ADC领域的一批企业之一。ImmunoGen正在开发下一代抗体-药物偶联物(ADC),以改善癌症患者的预后。通过开发具有增强抗肿瘤活性和良好耐受性的靶向疗法,我们旨在破坏癌症的进展并为我们的患者提供更多美好时光。
一键查询药企基本信息与企业画像
截图来源:药融云投融资数据库
药融云数据vip.pharnexcloud.com/?mh显示:1989年ImmunoGen在纳斯达克上市,2023年4月底市值不到10亿美元,5月3日公司股价大涨后市值增至28亿美元。凭借ImmunoGen良好的临床数据与超预期的销售额,ImmunoGen股价自2023年以来已大涨200%。截至2022年12月31日,ImmunoGen拥有277名全职员工,其中有155名研发人员。
此前,ImmunoGen与第一三共、Seagen被认为拥有最强的海外ADC技术平台。ImmunoGen公司的ADC平台历史悠久、技术领先,构建了靶点筛选、抗体开发、毒素库、连接子库四位一体的ADC工具库。ImmunoGen的技术曾催生了历史销量第一的ADC Kadcyla。
关于Kadcyla
Kadcyla由罗氏和ImmunoGen共同研发,于2013年2月22日被FDA批准用于HER2阳性转移性乳腺癌。Kadcyla由微管抑制剂DM1通过不可清除的硫醚键连接子与靶向HER2的人源化IgG1偶联,经过受体介导的内化被溶酶体溶解,使DM1降解产物在肿瘤细胞内释放致使细胞凋亡。2020年NMPA批准上市,成为国内第一款上市的ADC。2021年全球ADC市场规模超过52亿美元,其中Kadcyla独占半壁江山,销售额达到21.7亿美元。
三、研发管线
ImmunoGen布局产品线
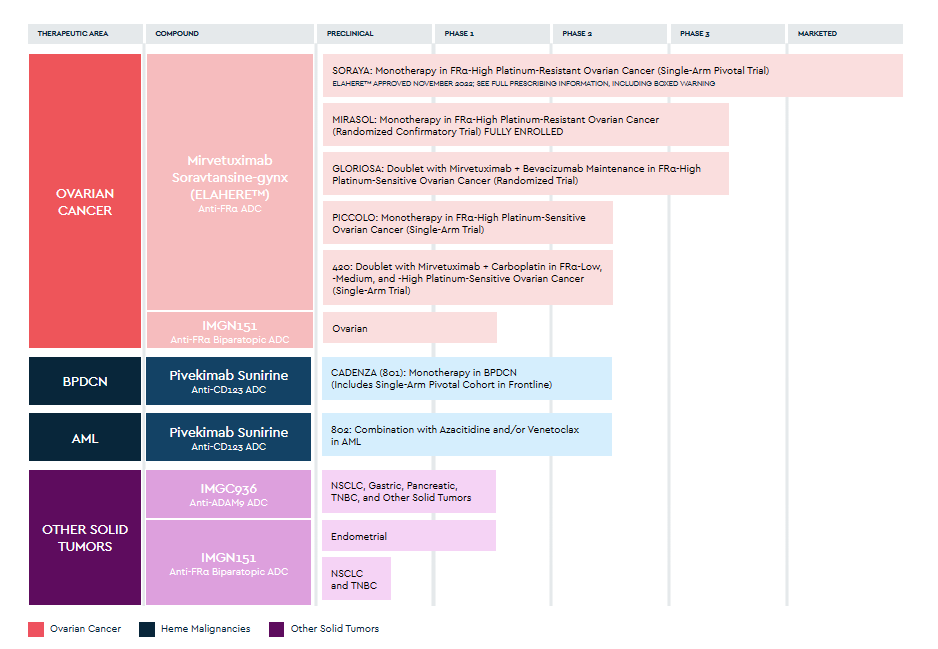
ImmunoGen目前有4款候选ADC药物,研发管线覆盖卵巢癌、恶性肿瘤和实体瘤领域。
➤ELAHERE®(mirvetuximab soravtansine-gynx)是全球首个靶向叶酸受体α的ADC药物,用于治疗上皮性卵巢癌、子宫内膜腺癌、三阴性乳腺癌和非小细胞肺癌等。
➤Pivekimab sunirine(IMGN632)靶向CD123,针对母细胞性浆样树突细胞肿瘤(BPDCN)和急性髓性白血病(AML)。目前处于临床II阶段。
➤IMGC936是全球首款靶向ADAM9的ADC,与MacroGenics共同开发,用于治疗非小细胞肺癌,胃癌,胰腺癌,三阴性乳腺癌和结直肠癌等实体瘤。在2021年的AACR上公布的数据显示出IMGC936在多种实体瘤中良好的活性,目前处于I期临床阶段。
➤IMGN151是下一代的抗FRα候选产品,期望能将适应症扩大到FRα低表达的更多肿瘤类型中。目前IMGN151已提交了IND申请。
截图来源:药融云全球药物研发数据库
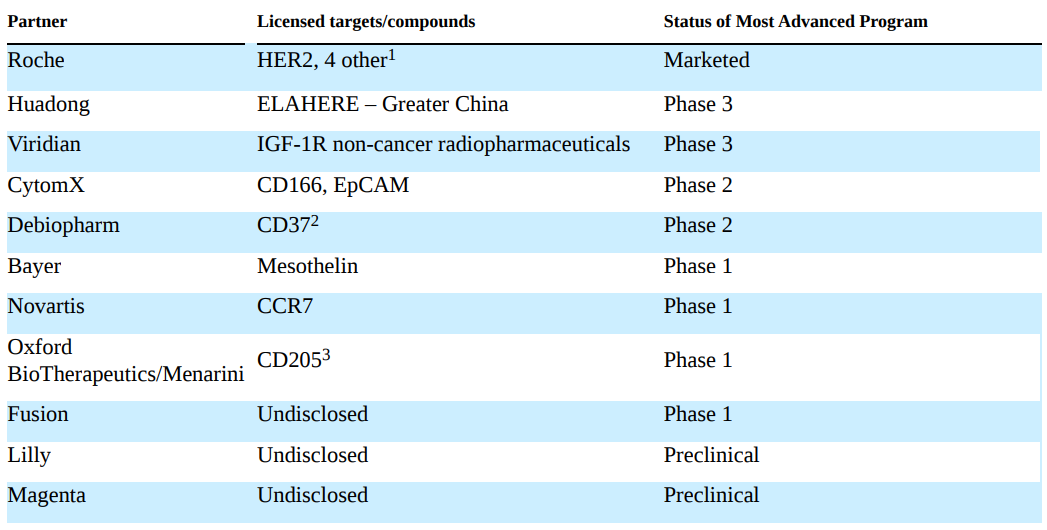
除了自研管线,对外合作授权一直是ImmunoGen公司的强项。在40年的时间里,通过对外合作ImmunoGen构建了世界上最复杂的ADC“工具箱”,重要的合作项目如下(截至2022年12月31日):
四、关于FRα ADC ELAHERE

ELAHERE为ImmunoGen合作开发的针对叶酸受体α(FRα,一种在卵巢癌中高表达的细胞表面蛋白)靶点的全球首创(first-in-class)ADC药物,由FRα结合抗体、可裂解的连接子和美登木素生物碱DM4组成。2020年10月,华东医药以超3亿美元获得了该药在大中华区(含中国大陆、香港、澳门和台湾地区)的独家开发和商业化权益。
截图来源:药融云全球医药交易数据库
2022年5月23日,ImmunoGen宣布美国FDA已受理该产品的生物制品许可申请(BLA),并授予优先审评资格。2022年11月15日,ImmunoGen宣布该产品获得美国FDA加速批准上市。
ELAHERE研发现状
截图来源:药融云全球药物研发数据库
ELAHERE®是依据FDA的加速批准路径,基于关键性单臂研究SORAYA试验的客观缓解率(ORR)和缓解持续时间(DOR)数据获得批准。SORAYA试验是一项单臂研究,入组106名铂耐药卵巢癌患者,患者入选标准是FRα高表达、先前已接受过1-3线治疗方案且至少接受过一线含贝伐珠单抗治疗的铂耐药卵巢癌患者。所有患者每3周接受6mg/kg的mirvetuximab soravtansine静脉输注,直到疾病进展或不可接受的毒性。该研究的主要终点为经研究者评估的ORR,关键次要终点为DOR。研究者评估的ORR为31.7%,包括5例完全缓解(CR)。研究者评估的中位DOR为6.9个月。

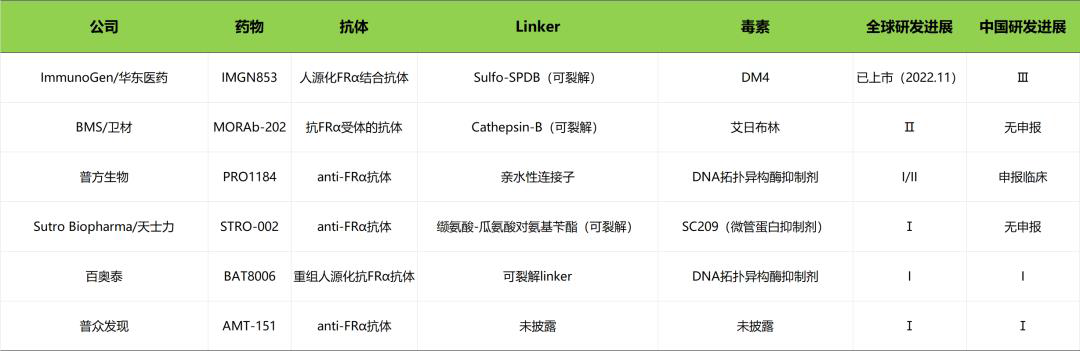
五、FRα靶点:下一个竞逐激烈的赛道
叶酸受体(Folate Receptor,FR)是一种糖基磷脂酰肌醇偶联蛋白,包括FRα、FRβ和FRγ三种。其中研究最为深入的是FRα,FRα分子量约为38~40KD,由257个氨基酸残基组成。FRα在正常组织中低表达,但在肿瘤组织中呈高表达,如卵巢癌(82%高表达)、非小细胞肺癌(83%高表达)、乳腺癌(32%高表达)、恶性间皮瘤(39%高表达)和子宫内膜癌(90%高表达)。
已有研究显示,FRα通过参与叶酸代谢、雌激素受体调控及细胞外信号调节激酶(ERK)信号通路等多种途径影响肿瘤的发生和发展。目前,FRα参与肿瘤的具体机制仍不清楚,可能存在下列几种机制:一方面,FRα的过表达调节叶酸摄取,激活肿瘤生长信号,促进DNA合成和肿瘤细胞的增殖;另一方面,FRα可增强肿瘤细胞的抗细胞凋亡能力,诱导抗药性。因此,理论上通过抑制FRα可达到控制肿瘤转移和侵袭的作用。

(FRα在肿瘤组织中高表达)
目前,全球针对FRα靶点的开发可谓百花齐放,包括FRα ADC、FRα CAR-T、单抗、双抗等,其中,卫材的FRα单抗Farletuzumab在Ⅲ期临床试验中未达到PFS终点而停止研发,Endocyte旗下的小分子偶联药物Vintafolide因未达到主要终点而宣告失败。FRα将何去何从?近年来,FRα ADC凭借卓越的疗效和安全性,逐步脱颖而出,随着首款FRα ADC药物ELAHERE®于2022年11月获FDA批准上市,FRα ADC前景值得期待,2023年有望成为FRα大红大紫的年份。ELAHERE®目前在中国处于Ⅲ期临床,有望于2023年下半年递交上市申请。
六、ELAHERE®三期临床试验MIRASOL获得成功,市场沸腾
2023年5月3日,ImmunoGen宣布了来自III期确认性MIRASOL试验(GOG 3045/ENGOT OV-55)的积极顶线数据,该试验评估了ELAHERE®(mirvetuximab soravtansine-gynx)联合化疗在受过1-3线治疗的叶酸受体α(FRα)阳性铂类耐药性卵巢癌患者中的安全性和疗效。根据这些数据,该公司计划提交欧洲的市场授权申请(MAA)和美国的补充生物制品许可申请(sBLA),以将ELAHERE转换为正式批准。
ELAHERE®的成功不仅拯救了ImmunoGen,而且打开了ADC治疗卵巢癌的想象空间,Mersana股价涨46%,Sutro股价涨11.3%。

MIRASOL(NCT04209855)是一项随机的第三期试验,比较ELAHERE与研究者选择(IC)的单药化疗(每周紫杉醇、聚乙二醇化脂质型阿霉素或托泊替康)。符合条件的患者包括铂类耐药性卵巢癌患者,其肿瘤表达高水平的FRα(使用Ventana FOLR1检测),并已接受最多三个前期方案治疗。该试验的主要终点是研究者评估的无进展生存期(PFS)。关键的次要终点包括客观缓解率(ORR)和总生存期(OS)。
主要阳性发现:
MIRASOL共招募了453名患者;14%的患者接受过一线治疗,39%的患者接受过两线治疗,47%的患者接受过三线治疗。62%的患者接受过前期贝伐单抗治疗;55%的患者接受过前期PARP抑制剂治疗。截至2023年3月6日的数据截止日期,OS的中位随访时间为13.1个月;ELAHERE组有14%的患者仍在接受研究药物治疗,而IC化疗组只有3%的患者。
ELAHERE相较于IC化疗,在OS方面表现出具有统计学意义和临床意义的显著改善。截至2023年3月6日,报告了204个OS事件,ELAHERE组的中位OS为16.46个月,而IC化疗组为12.75个月,其风险比(HR)为0.67,p=0.0046。这意味着与IC化疗组相比,ELAHERE组死亡风险降低了33%。
ELAHERE相较于IC化疗,在研究者评估下PFS方面表现出具有统计学意义和临床意义的显著改善,其风险比为0.65(p<0.0001),这意味着与IC化疗组相比,ELAHERE组肿瘤进展或死亡的风险降低了35%。ELAHERE组的中位PFS为5.62个月,而IC化疗组为3.98个月。
研究者评估下,ELAHERE组的ORR为42.3%,其中包括12个完全缓解(CR),而IC化疗组的ORR为15.9%,没有CR。
盲审独立中央评估的PFS和ORR结果与研究者评估结果一致。
ELAHERE的安全性特征仍然主要是低级别的眼部和胃肠道事件。没有发现新的安全信号。与IC化疗相比,ELAHERE相关的以下发生率更低:
(1)n3级或更高级别的治疗相关不良事件(TEAE)(42%对54%);
(2)n严重不良事件(24%对33%);以及
(3)n导致停止研究药物的TEAE(9%对16%)。
关于卵巢癌
卵巢癌是美国妇科癌症死亡的主要原因。每年大约有2万名患者被诊断出患有该病,其中有1.3万名患者会死亡。大多数患者出现晚期疾病,通常会接受手术治疗,随后进行铂类化疗。不幸的是,大多数患者最终会发展为耐铂性疾病,这种疾病难以治疗。在这种情况下,标准的单一药物化疗方案与低反应率、短持续时间的反应以及重要的毒性相关联。
七、财务状况

(ImmunoGen2022财年营收来源结构)
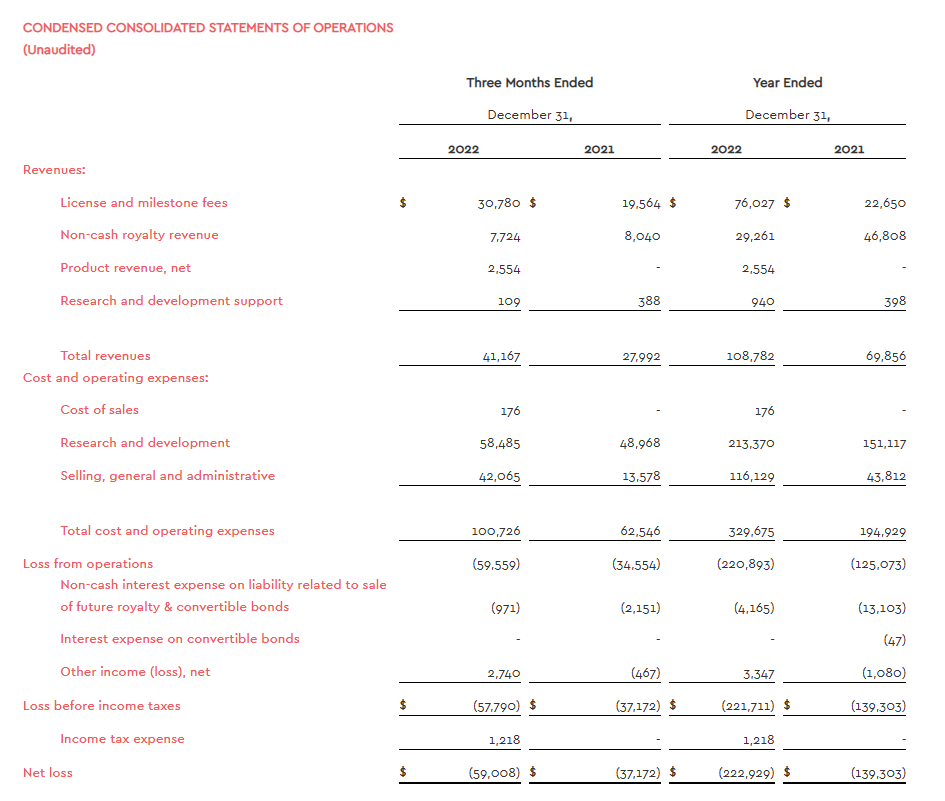
从公司的财务状况看来,技术授权许可费仍是ImmunoGen目前主要的收入来源。根据公司2023年3月1日发布的2022年财报,2022年公司总营收1.09亿美元,同比增加55.72%,主要来自于华东医药、Viridian公司授权合作的一笔里程碑付款,以及与礼来和Magenta授权合作的一次性许可费用。
Elahere是公司唯一一款上市产品,为全球首款靶向FRα-ADC药物,2022年年底才获得FDA批准加速上市,根据公司财报,2022年Elahere净收入约260万美元。2023年4月28日,ImmunoGen2023年一季报显示,ELAHERE®上市后一季度销售额为2950万美元。
2022年ImmunoGen的净利润为-2.23亿美元,同比下降60.03%。2022财年研发费用投入2.12亿美元,相较于2021年投入的研发费用1.51亿美元,增长了6225万美元,再加上销售费用,一般和行政支出等等运营成本,2022年该公司总的成本花销为3.3亿美元,相较于2021年的运营成本,增长近1.35亿美元。
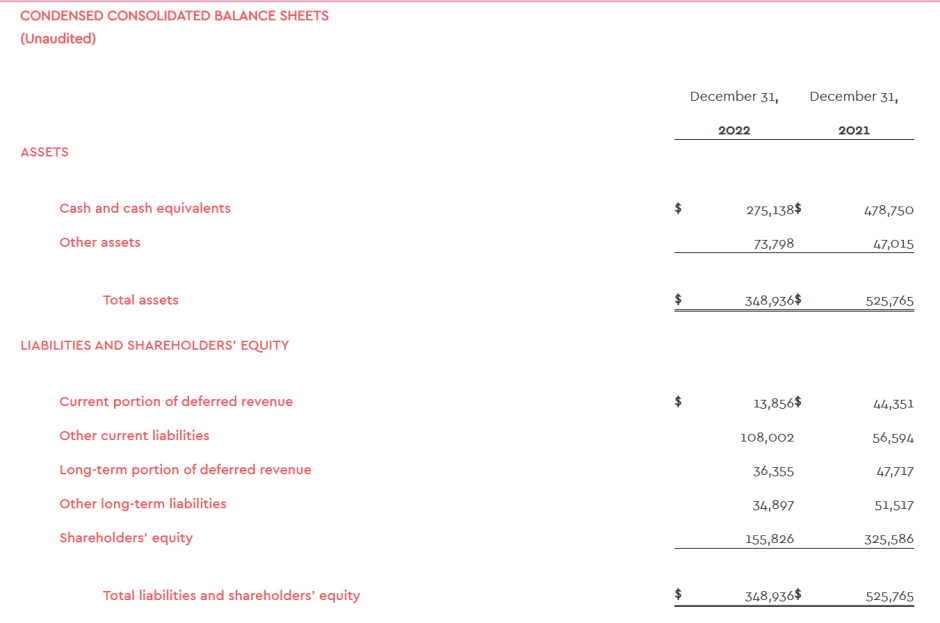
截至2022年12月31日,ImmunoGen持有现金和现金等价物共计2.751亿美元。ImmunoGen称,此现金水平和现金等价物不足以满足公司在未来12个月的当前运营计划。此前,在2023年4月6日,ImmunoGen公司宣称,已与Pharmakon Advisors(生命科学行业领先的债务资本提供商)签订了贷款协议,Pharmakon向ImmunoGen提供一项1.75亿美元的非稀释性定期贷款。
根据协议条款,该笔贷款将分两次向ImmunoGen提供,第一笔为7500万美元,在协议签订时支付;第二笔5000万美元的款项,在ImmunoGen开展的mirasol试验获得积极顶线数据以及Elahere™(mirvetuximab soravtansine-gynx)达到净销售目标后提供。另外,经双方同意,这一部分可增加到1亿美元。贷款将在初始供资后五年内到期;在前36个月内,付款将只收取利息,如果满足某些条件,则可延长12个月,之后将开始按比例支付剩余贷款的本金。利息将按三个月担保隔夜融资利率累计,下限为2.75%,外加每年8.00%。

此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据库vip.pharnexcloud.com/?mh;
FDA/EMA/PMDA;
相关公司公开披露;
https://www.immunogen.com;
https://investor.immunogen.com/static-files/c13665c0-ef8c-4529-9f67-faa0ff4db62a;
https://investor.immunogen.com/news-releases/news-release-details/ImmunoGen-reports-recent-progress-and-2022-financial-results https://mp.weixin.qq.com/s/to6BlRaB5y0UTk1LiVIlKA;
https://caifuhao.eastmoney.com/news/20220610144616317024060;
https://www.nature.com/articles/s41392-022-00947-7;
https://www.targetedonc.com/view/mirvetuximab-soravtansine-proves-safe-and-effective-in-fr--high-ovarian-cancer;
https://mp.weixin.qq.com/s/OBKvXqZ5OpjGzvrrtaRfGw;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论