创新药研发需要经过多个研究阶段,其中IND申报是第一个重要节点,也是创新药迈向成功的第一步,IND阶段的研究是后续临床研究的重要基础。
IND申报阶段的研究工作包括药学研究(CMC)、临床前的毒理、药效、药代、药动学等研究。其中药学研究是药物研发的重要组成部分,对非临床和后续临床研究试验提供技术和物质支持,它由三个部分组成:原料药(C)、制剂(M)、质量(C)。其中质量是衔接原料药和制剂的桥梁,且贯穿新药研发的全生命周期,是安全性、有效性的重要保障。
那么在IND申报阶段需要开展哪些质量相关的工作呢?其实通过解读指导原则不难总结出需要开展哪些工作,但是具体怎样开展?需要注意哪些细节指导原则并没有给给出答案,本文的目的是以指导原则为前提,结合自己的经验谈一谈在创新药IND申报阶段质量研究的工作内容及相关实施策略。
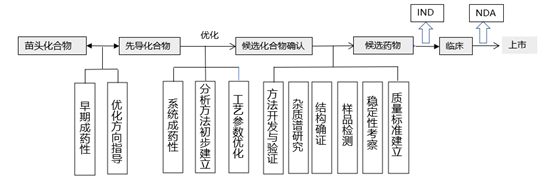
创新药IND申报阶段质量研究的内容
一、原料药质量研究
原料药和制剂是质量研究的两个媒介基础,原料药质量研究是药学研究工作开展以及药效和安全性评价工作开展的重要物质基础。在创新药IND申报阶段,原料药质量研究的具体工作有以下几个部分。
1.类药性考察
新药研发过程中,候选化合物的确认是一项具有重大意义的里程碑。不难想象,一个化合物从苗头化合物,到先导化合物,在再到确认为候选药物并申报I其临床研究需要经过一个迂回反复的过程和递进式的筛选,在这个过程中各个专业研究人员各显其能,从各自专业的角度从众多化合物中筛选出最可能成为药物的化合物,也就是开展类药性评价。在研发早期,类药性是筛选化合物的重要指标,是将理化性质与体内行为联系起来的重要手段。
(1)溶解性:考察化合物在不同pH缓冲液中的溶解度,以对化合物在体内的吸收情况有初步预测。pH设置通常模拟并覆盖药物在体内吸收所涉及的各个部位的pH,如pH1.2、4.5、6.8、7.4是常常需要考察的pH。
(2)亲脂性:化合物的脂溶性直接影响化合物的透膜性、溶解性、毒性、分布容积和蛋白结合率,是类药性的重要指标。在开发早期考察化合物亲脂性,尤其是logD(6.5&7.4)可以对化合物的ADME进行初步预测。
(3)解离常数:通过化合物解离常数可以判断化合物在不同的吸收部位是分子状态还是离子状态,从而可以粗略预判化合物在不同的吸收部位的吸收情况。同时也可以根据化合物的解离常数对排泄器官pH进行调节从而调节化合物的排泄。
(4)稳定性:对化合物的固有稳定性进行初步考察,包括高温、高湿、光照条件下的稳定性、加速稳定性和长期稳定性,对于稳定性明显较差的化合物可以根据稳定性的程度设计不同程度的考察条件。稳定性的考察结果不仅对后续的储存运输有一定的指导意义,从稳定性的角度也可以对一系列的待筛选化合物进行评分,排除不适宜继续开发的化合物。例如化合物A和B药效、安全性、亲脂性、溶解性等指标均相近,但A的稳定性明显差于B,那么经过稳定性考察可以将A排除。
2.分析方法初步开发
研究早期分析方法开发注重通用性,分析方法可以适当粗糙,能够对不同样品进行评比打分即可。该方法可用于早期药理试验用样品检测和后续的工艺路线选择与工艺优化。
3.药理试验样品检测
在候选化合物基本确定后,会开展化合物的毒理和药效试验,采用初步建立的分析方法考察药理试验用样品是否满足药理试验要求。
4.工艺路线选择与优化
对不同路线和工艺下的产品进行检测,从产品杂质谱和杂质含量的角度对路线进行选择,对工艺参数进行优化。
5.质量控制
5.1起始物料质量控制
“原料药的起始物料”是指其关键结构将进入原料药中的一种原料、中间体或用来生产该原料药的一种活性原料成分,原则上市售的、按合同或商业协议从一个或多个供应商处购得的或者企业自制的都可以作为起始物料。多数情况下,起始物料都是从供应商处购买的。在起始原料质量控制方面的工作有以下几项:
(1)辅助确定生产商:对不同厂家起始物料和相应的终产品进行检测,考察不同厂家起始物料对终产品质量的影响,辅助确定生产商。
(2)控制策略制定:大多数创新药的反应步骤不多(通常为3步反应),因此起始物料的质量往往会直接影响终产品质量以及工艺的稳定性。起始物料的质量控制首先考察COA报告中的质控项目和限度的设置是否能满足稳定产生符合要求的终产品,是否需要添加对终产品质量影响较大的重要控制项目,而对于那些对终产品质量无显著影响的项目可以酌情删除。总之,直接采用COA还是建立内控标准,应视起始物料的各控制项目对后续反应和终产品质量的影响而决定。
(3)杂质的控制:对于DNA反应性杂质、对后续反应或终产品质量有影响的杂质、残留溶剂一、二类溶剂和一些毒性较大的无机杂质(如重金属)需要根据工艺路线和杂质在反应中的清除情况来确定控制策略。如果具有手性中心,要把异构体杂质作为关键杂质进行控制。对于普通有机杂质可以依据COA的限度来加以控制。三类残留溶剂和普通无机杂质通常在终产品中进行控制,在起始物料中可以不设置控制项。
(4)结构确证:对起始物料和关键杂质进行结构确证(质谱、核磁)
(5)分析方法优化和验证:首先考察起始物料厂家提供的COA报告中的方法是否适用,能否满足我们预设的灵敏度和专属性,如果满足,可以直接采用COA报告中的分析方法,否则,需要对方法进行优化。以COA提供的方法为基础,适当对色谱柱、流动相pH、缓冲盐种类、缓冲盐浓度或酸浓度、流动相梯度等条件进行筛选和优化。对优化所得的分析方法进行验证,在IND申报阶段,进行专属性、灵敏度和溶液稳定性验证即可。
(6)样品检测和数据积累。
5.2中间体
中间体是原料药工艺合成过程中产生的一种物料,经过进一步分子变化或精制可以成为原料药。中间体尤其是关键中间体质量对成品质量有显著影响。在中间体质量控制过程中需要完成的工作包括以下几项:
(1)控制策略制定:中间体中可能存在起始物料、副产物或降解产物,对于那些含量较高或可对后续反应和终产品有明显影响的杂质应进行详细研究和控制。最后,依据合成工艺,结合对工艺过程中的关键控制点的认识,制定中间体的内控标准。
(2)结构确证:对中间体和关键杂质进行结构确证(质谱、核磁)。
(3)分析方法开发:依据中间体质量控制的需求,开发相应的分析方法,通常涉及有关物质方法的开发。
(4)分析方法验证:中间体分析方法验证仅进行部分关键验证即可,包括专属性、灵敏度和溶液稳定性。
(5)样品检测和数据积累。
(6)质量标准:依据合成工艺和样品检测数据统计,建立中间体的内控标准,控制限度可以适当放宽。
5.3成品
(1)控制策略制定
原料药控制项目可分为一般控制项目和个性化控制项目:一般控制项目如性状、鉴别、含量、有关物质,个性化控制项目根据产品拟定的给药方式和自身特点来设置,如口服制剂的晶型和粒度,注射液的细菌内毒素和不溶性微粒等。依据ICH 指导原则原料药中杂质可分为残留溶剂、无机杂质和有机杂质。其中有机杂质就是所熟知的有关物质,是影响产品质量的重要因素。有关物质来源包括起始物料、中间体及及其关键杂质的残留、降解产物、副产物、异构体转化等。对于创新药中的有关物质,一般杂质限度可依据ICH Q3A制定,特定杂质限度需根据杂质安全性、工艺可行性和产品稳定性综合制定。对于DNA反应性杂质根据ICH M7指导原则进行控制;无机杂质中需重点关注的是金属类杂质,其控制限度参考ICH Q3D制定;残留溶剂控制限度参考ICH Q3C制定。对于杂质的控制方式可以有几种不同的方式:一是终点控制,二是中控检测+终点控制,三是基于对工艺参数及其对残留杂质水平(包括去向和清除知识)的影响的了解,确信原料药中的相应的杂质水平将会低于可接受限度,并有多批数据作为支撑,对相应杂质不做控制。
(2)结构确证和对照品标化
对原料药进行全面结构分析和确证包括UV、IR、MS、NMR(全套)、XRD、MXRD、EA、DSC等。当存在异构体杂质时,应对异构体杂质进行部分结构确证,包括MS、NMR(全套)、MXRD,其他杂质进行MS和NMR结构确证。同时对原料药及杂质对照品进行标化。对于多肽化合物还需提供氨基酸序列、氨基酸组成分析、高级结构确定等信息。
(3)理化性质研究
理化性质研究包括两部分,一部分是普通理化性质,包括性状、熔点、比旋度,引湿性等,一部分是关键理化性质,通常与制剂性能相关,如晶型、溶解度、渗透性、粒度等。
(4)分析方法开发
依据原料药质量控制项目,开发相应的分析方法,如有关物质、残留溶剂、DNA反应性杂质、元素杂质、含量等。残留溶剂、元素杂质、DNA反应性杂质、含量等方法开发需完全满足指导原则的要求。
(5)方法验证
在IND申报阶段,不需要进行全面的方法学验证,但专属性、灵敏度等关键项目是必须验证的项目。由于分析方法随分析对象而变化,且各具特点,因此难以确定统一的验证标准,通常在IND申报阶段在有充分理由的情况下验证标准可以适当放宽。
(6)样品检测与数据积累
重点关注用于安全性研究、稳定性研究、临床研究等批次样品的检测结果。
(7)杂质谱初步解析
基于工艺条件和现有的知识对降解杂质、样品中含量超过鉴定限的杂质进行解析,分析其产生的条件和结构。并将研究结论融入到质量控制的过程中,为杂质控制策略的制定提供依据。
(8)包装系统选择
旨在对包装材料选择提供依据,即影响因素试验(采用内包材与采用称量瓶两种形式对比)或加速、长期稳定性试验条件下获得的重点检查项目的结果与0天全检数据对比,考察内包材选择是否适宜。通常可以和稳定性研究部分合并考察。
(9)稳定性
原料药稳定性包括影响因素(1批供试品)、加速和长期稳定性(3批供试品)。稳定性考察条件参照ICH Q1A和中国药典四部通则9001稳定性指导原则设定(注意需低温保存的原料药的考察条件设置)。简要讨论稳定性考察相关的结果、结论,说明拟定的贮藏条件、复检日期或有效期。除注册批、临床批等样品的稳定性,还应对毒理批样品的稳定性进行考察,考察时间至少要覆盖毒理试验周期。
(10)制定质量标准
依据前期研究数据和新药研究各项指导原则,初步建立原料药的质量标准并说明质量标准的制定依据。
二、制剂质量研究
制剂质量研究内容主要有质量控制、稳定性、包装和贮存、安慰剂等。
(1)控制策略制定
制剂样品应根据拟选定的剂型和产品特点等来设置质控项目和分析方法。制剂中杂质分为工艺杂质、降解杂质、原辅料药引入杂质及外来物迁移(包材相容性杂质、生产组件)。其中含量超过鉴定限的工艺杂质和降解杂质是研究重点。与原料药一样,创新药制剂中一般杂质限度参照ICH Q3B制定,特定杂质制定应依据工艺可行性、稳定性和产品安全性综合制定,尤其要确保杂质限度的制定有足够的安全性数据支持。
(2)分析方法开发
首先尝试原料药分析方法,如果适用则直接使用同一方法,有助于后期杂质谱比对工作,如果方法不适用,则需要进一步优化。对于有关物质方法,由于现阶段尚处于对杂质安全性的初步研究阶段,对某些杂质可以容忍未达基线分离甚至合并控制。此外在制剂方法开发过程中注意考察辅料空白对杂质检测的干扰。
(3)分析方法验证
在IND申报阶段,不需要进行全面的方法学验证,但专属性、灵敏度等关键项目是必须验证的项目。由于分析方法随分析对象而变化,且各具特点,因此难以确定统一的验证标准,通常在IND申报阶段在有充分理由的情况下验证标准可以适当放宽。
(4)结构确证和对照品标化
对API及杂质对照品进行结构确证,可引用原料药相对应的数据。
(5)杂质谱初步解析
基于工艺条件和现有的知识对降解杂质、样品中含量超过鉴定限的杂质进行解析,分析其产生的条件和结构,并将研究结论融入到质量控制的过程中,为杂质控制策略的制定提供依据。
(6)稳定性研究
在不采用括号法和矩阵设计的情况下,每一种规格和包装规格的制剂都应进行稳定性研究。制剂稳定性包括影响因素(1批供试品)、加速和长期稳定性(3批供试品)。稳定性考察条件参照ICH Q1B和中国药典四部通则9001稳定性指导原则设定。注意需低温保存的原料药的考察条件设置以及产品使用中稳定性考察。简要讨论稳定性考察相关的结果、结论,说明拟定的贮藏条件、复检日期或有效期。除注册批、临床批等样品的稳定性,还应对毒理批样品的稳定性进行考察,考察时间至少要覆盖毒理试验周期。确保稳定性数据能够支持在计划的临床研究期间所研制的新药符合初步拟定的质量标准要求。
(7)安慰剂研究
安慰剂也叫模拟药物,是在制剂的基础上去除原料药而成。安慰剂没有药效,也没有毒副作用,常用作药理试验的对照品。安慰剂也需进行全面的质量控制,并与制剂在相同的条件下稳定性研究。
(8)样品检测与数据积累
重点关注用于安全性研究、稳定性研究、临床研究等批次样品的检测结果。
(9)制定质量标准
依据前期研究数据和新药各项指导原则,初步建立制剂的质量标准并说明质量标准的制定依据。
创新药研发具有渐进性和不确定性,研究工作应遵循其规律开展。在IND申报阶段,安全性是重点考量的问题,质量研究工作也应以支持安全性为目的,在合规的大前提下,依据所研发品种的特征,科学合理的制定研究方案,以确保I期临床期间受试者的安全性。
<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论