2023年第一季度过去,据药融云统计,国家药品监督管理局(NMPA)Q1共批准了17款新药上市,受理了25款1类新药的上市申请,将14款药物纳入拟突破性治疗品种,20款药物纳入拟优先审评程序。详情如下。
其中,抗肿瘤新药研发在业内仍然火热,共有7款获批上市,为肺癌、乳腺癌、淋巴瘤等患者带来了新的药物选择;12款申报上市。另外,在本季度恒瑞医药可谓是收获颇丰,在新药上市,新药报产、突破性治疗、优先审评这4个方面均有药物涉足在内。
一、17款新药获批上市,7款为抗肿瘤新药
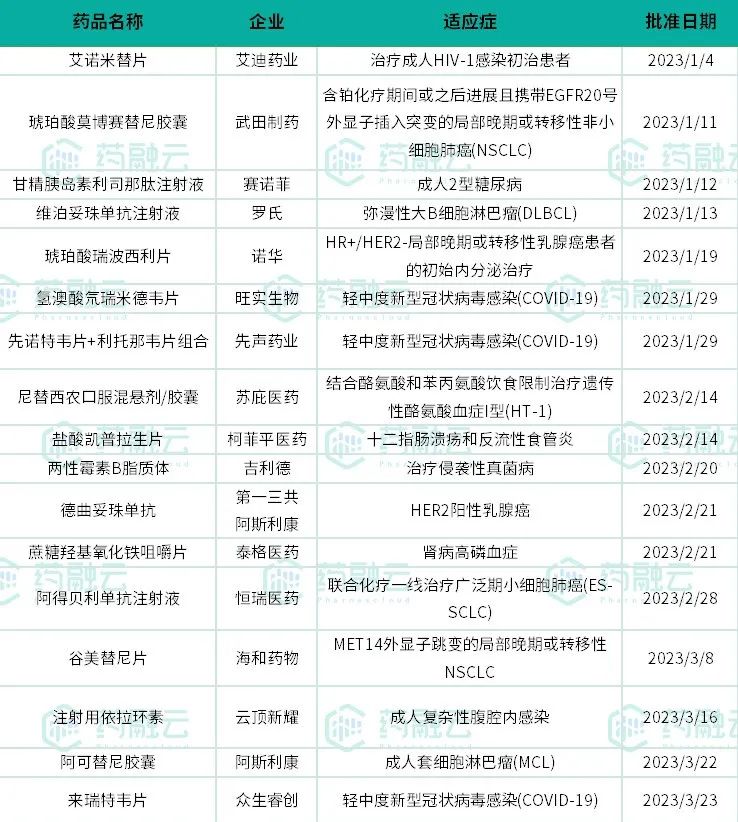
Q1获批上市的新药包括13款化药和4款治疗用生物制品。其中,艾迪药业、旺实生物、苏庇医药、柯菲平医药、泰格医药、恒瑞医药、海和药物、众生睿创等本土药企均有新药获批。
从治疗领域来看,武田制药的琥珀酸莫博赛替尼胶囊、罗氏的维泊妥珠单抗注射液、诺华的琥珀酸瑞波西利片、第一三共/阿斯利康的德曲妥珠单抗、恒瑞医药的阿得贝利单抗、海和药物的谷美替尼片和阿斯利康的阿可替尼胶囊等7款均为抗肿瘤新药,涉及肺癌、乳腺癌、淋巴瘤等癌种。
有3款新冠治疗药物获批上市,包括旺实生物的氢澳酸氘瑞米德韦片、先声药业的先诺特韦片+利托那韦片组合和众生睿创的来瑞特韦片。至此,我国共有6款新冠口服药获国家药监局批准上市,另外三款为阿兹夫定片(真实生物)、奈玛特韦片/利托那韦片组合包装(辉瑞)和莫诺拉韦胶囊(默沙东)。
2023年Q1获批上市的新药
数据来源、整理:药融云数据库
值得一提的是,艾迪药业的艾诺米替片是一款艾诺韦林、拉米夫定和富马酸替诺福韦二吡呋酯组成的复方制剂,其获批填补了国产创新成分单片复方制剂领域空白;阿得贝利单抗的获批,则是使恒瑞医药在抗肿瘤新药研发领域中的“龙头”地位更加稳固,成为全球首家同时拥有PD-1和PD-L1上市产品的药企。
二、25款1类新药申报上市,抗肿瘤新药研发依旧火热
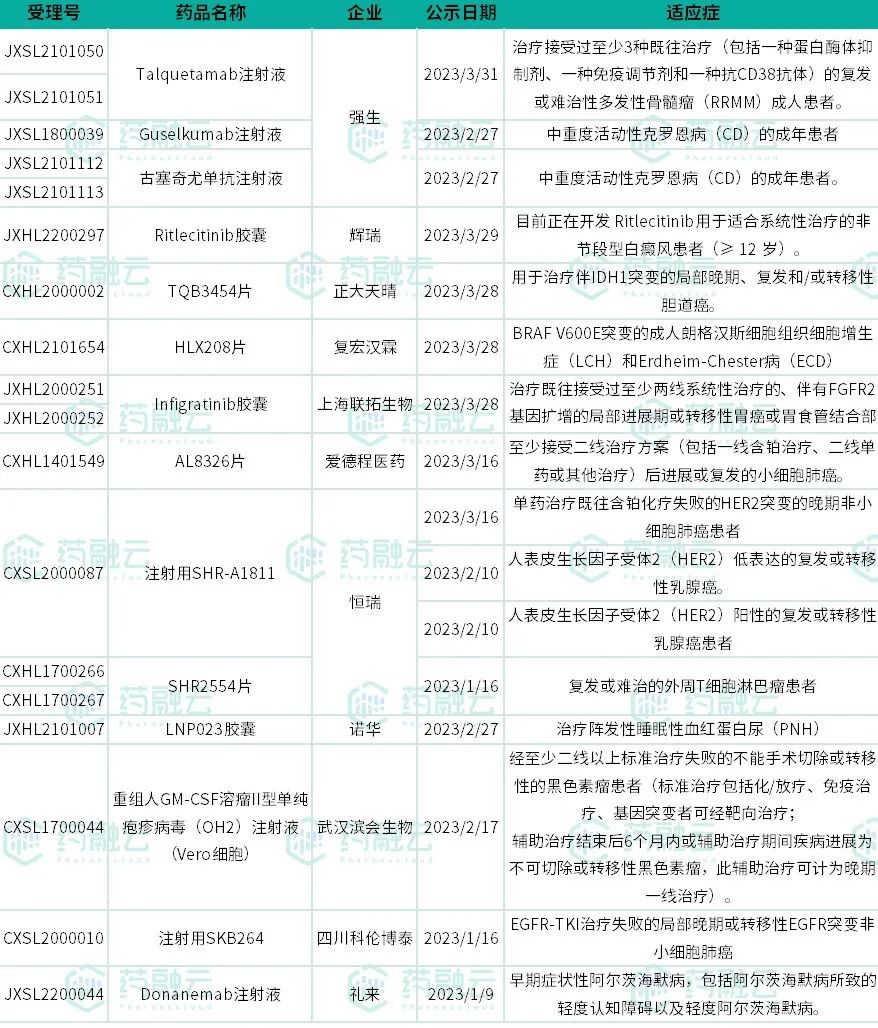
第一季度,NMPA共受理了25款新药的上市申请,合计37条受理号,包括19款化药、4款治疗用生物制品和2款中药。涉及恒瑞医药、扬子江、再鼎医药、罗氏、信达生物、迪哲医药、正大天晴、盛世泰科等企业。其中,抗肿瘤新药研发在业内仍然火热,嘉和生物、贝达药业、迪哲医药、康龙化成等药企均递交了新药上市申请。靶点方面,DPP4药物和EGFR药物均有3款进行上市申报。
2023年Q1申报上市的1类新药

数据来源、整理:药融云数据库
其中,来瑞特韦片已获批上市,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者,这是我国批准的第6款新冠治疗药物。
从治疗领域来看,抗肿瘤药和免疫机能调节药依旧是业内整体布局的重点,本次共有12款该领域药物申报上市;其次为消化系统与代谢药领域,共有8款药物报产,这其中还包括一款中药,为湖南时代阳光药业的玄黄润通片。值得一提的是,复格列汀(信立泰)、盛格列汀(盛世泰科)、瑞格列汀二甲双胍(盛迪医药)和HSK7653(海思科)均为II型糖尿病用药。
三、14款药物纳入突破性治疗品种,强生、恒瑞医药最多
2020年7月,国家药监局药品审评中心(CDE)首次提出突破性治疗药物审评工作程序,中国版的“突破性疗法”正式问世,明确在药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病有足够证据表明具有明显临床优势的创新药或者改良型新药等,可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。
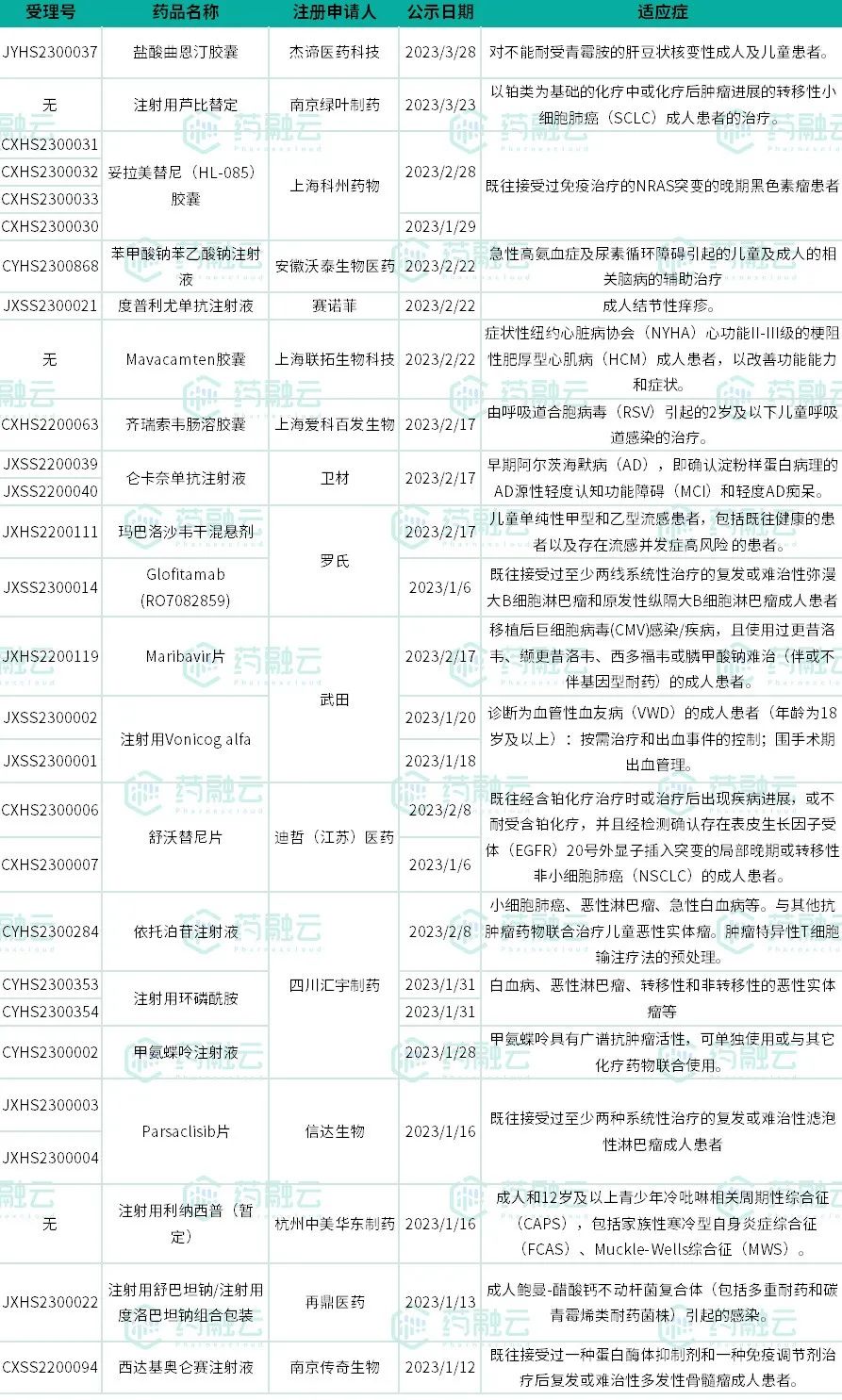
2023年Q1,共有14款药物纳入突破性治疗品种。这些品种有来自国际大型医药公司如强生、辉瑞、礼来,也有来自本土药企如恒瑞医药、正大天晴、复宏汉霖。其中,强生和恒瑞医药纳入品种最多,均有2款,前者有GPRC5D/CD3双抗Talquetamab和IL-23抑制剂古塞奇尤单抗被纳入突破性治疗品种;后者有SHR-A1811和SHR2554被纳入。
2023年Q1纳入的突破性治疗品种
数据来源、整理:药融云数据库
四、20款药物纳入优先审评品种名单
自2020年新修订《药品注册管理办法》建立优先审评程序,加快具有明显临床价值的药品上市速度,目前共有1428个受理号被纳入优先审评程序。今年第一季度共有20款药物的28个受理号被纳入,涉及卫材、罗氏、南京绿叶制药、信达生物、南京传奇生物等药企。
其中,赛诺菲的度普利尤单抗最早于2020年在国内获批上市,截至目前,共有3项适应症获批,分别为成人中重度特应性皮炎、12岁及以上的中重度特应性皮炎患者、6~12岁的中重度特应性皮炎患者。本次纳入优先审评程序的,是其关于成人结节性痒疹的上市申请。
2023年Q1纳入优先审评的品种
数据来源、整理:药融云数据库
参考来源:
[1] NMPA官网
[2] 药融云数据库
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论