
11月15日,中国国家药品审评中心(CDE)官网公布,海南倍特药业有限公司提交的注射用厄他培南的4类仿制药上市申请已被正式受理。该产品是社区感染(继发性的腹腔感染,复杂性皮肤及附属器感染,社区获得性肺炎,复杂性尿道感染,急性盆腔感染等)的一线治疗选择药物。

数据来源:中国国家药品审评中心(CDE)
一、厄他培南上市情况
据公开资料,注射用厄他培南属于第一类碳青霉烯类抗生素,具有广泛的抗菌谱,特别对产生ESBLs和AmpC酶的革兰阴性菌具有高效活性。据摩熵医药数据库显示,该药2001年11月21日获FDA获FDA批准首次上市,次年4月18日在欧洲上市,2005年9月12日原研默沙东递交的上市申请获NMPA批准,正式进入国内市场。
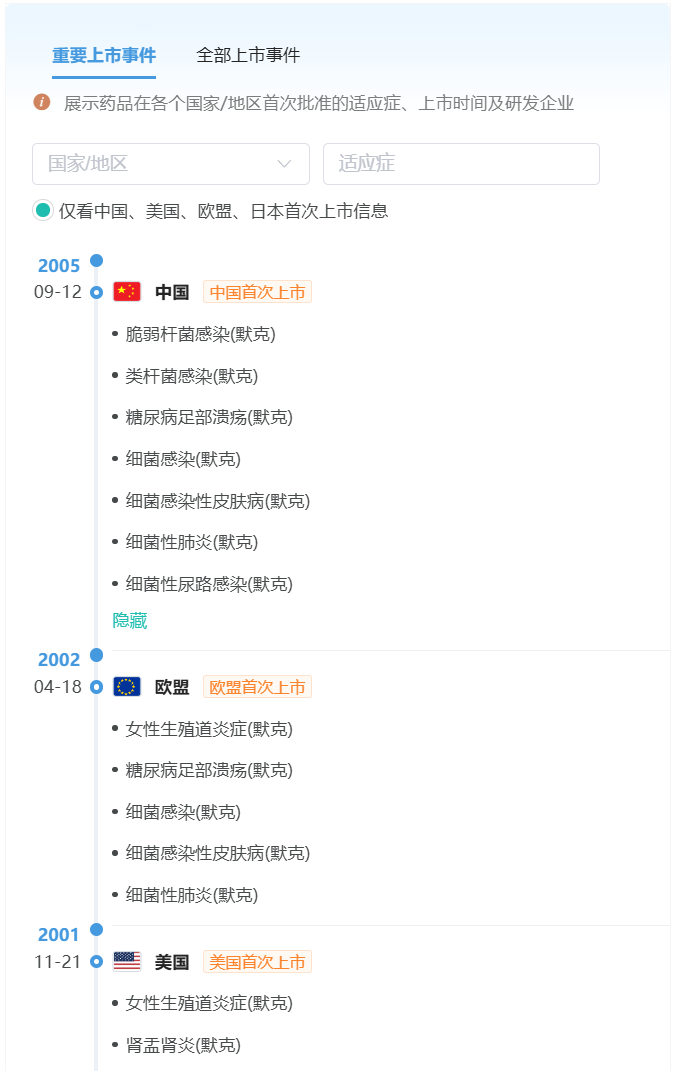
数据来源:摩熵医药全球研发数据库
国内研发历程如下:

数据来源:摩熵医药全球研发数据库
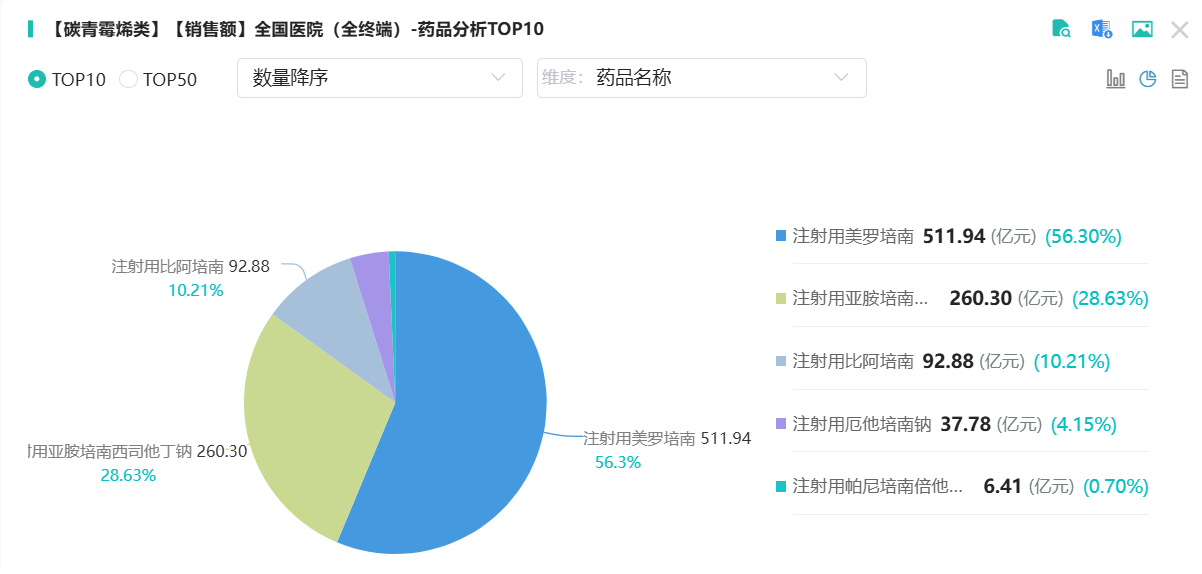
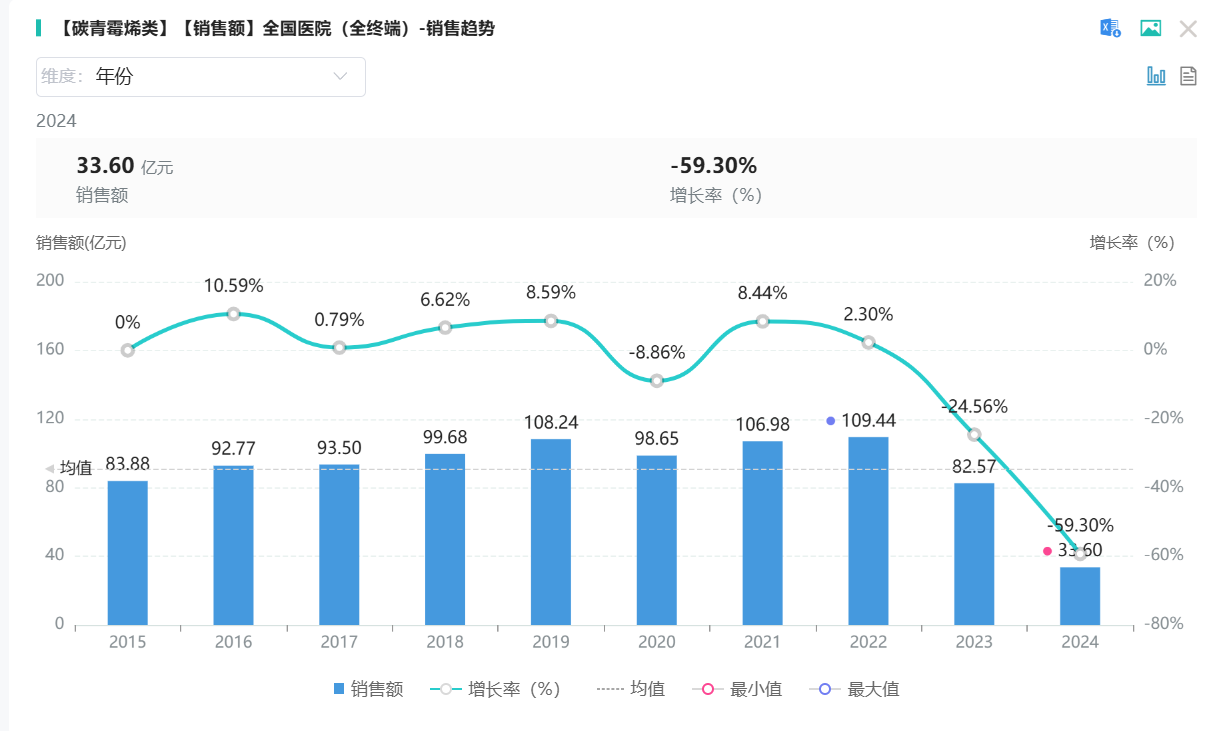
除了原研药企,国内已有五家公司获得生产该药品的批准,分别是重庆圣华曦药业股份有限公司、海南合瑞制药股份有限公司、四川制药制剂有限公司、石药集团欧意药业有限公司和齐鲁安替制药有限公司。在这些企业中,石药集团欧意药业有限公司的注射用厄他培南钠在2013年率先获得上市批准,成为首家仿制药。目前,该药物已满足集中采购的条件,形成了5家仿制药企业加上1家原研企业的“5+1”竞争格局。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论