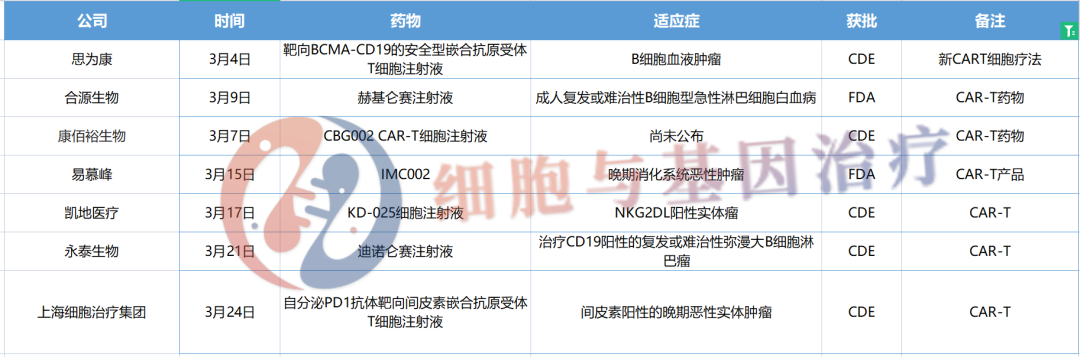
细胞疗法作为一种革命性的疗法,为诸多难治性肿瘤患者带来了治愈的希望。为了能够给更多患者带来有效的产品,国内有多家细胞疗法企业对实体瘤领域展开了探索,并取得了可喜的进展。据药融云数据库统计,3月,就有7款CAR-T细胞疗法IND申请获受理。其中涉及到的公司有思为康、合源生物、康佰裕生物、易慕峰、凯地医疗、永泰生物和上海细胞治疗集团。
3月IND申请获受理的CAR-T细胞疗法盘点
图片来源:细胞基因治疗前沿
01.思为康
3月4日,据药融云中国药品审评数据库显示,湖南思为康医药有限公司自主研发的“靶向BCMA-CD19的安全型嵌合抗原受体T细胞注射液”临床试验申请获得受理(受理号:CXSL2300169)。

截图来源:药融云中国药品审评数据库
该项目目前处于新药临床批件申报当中,后续将通过完成一期、二期、三期临床实验实现产品上市,适应症为复发及难治性血液肿瘤,力争推出湖南第一款CAR-T细胞疗法上市产品。
02.合源生物
3月9日,合源生物宣布,赫基仑赛注射液(拟定)(CNCT19细胞注射液,Inaticabtagene Autoleucel)IND申请已获FDA许可,用于治疗成人复发或难治性B细胞型急性淋巴细胞白血病(r/r B-ALL)。
赫基仑赛注射液是首个在中国递交新药上市申请(NDA)的具有完全自主知识产权的靶向CD19的CAR-T细胞疗法产品, 有望年内获得批准上市。
03.康佰裕生物
3月7日,据药融云数据库显示,浙江康佰裕生物科技有限公司提交的"CBG002 CAR-T细胞注射液"临床试验申请获得受理(受理号:CXSL2300174)。

截图来源:药融云中国药品审评数据库
目前没有这款CAR-T细胞疗法疗法产品的官方信息披露。这也是康佰裕生物首款申报的生物创新药。
04.易慕峰
3月15日,易慕峰宣布其自研产品IMC002,即靶向CLDN18.2的自体CAR-T细胞疗法产品的IND申请获得美国FDA许可,适应症为CLDN18.2表达阳性的晚期消化系统恶性肿瘤,包括但不限于晚期胃癌、食管胃结合部腺癌、晚期胰腺癌。

截图来源:药融云中国药品审评数据库
05.凯地医疗
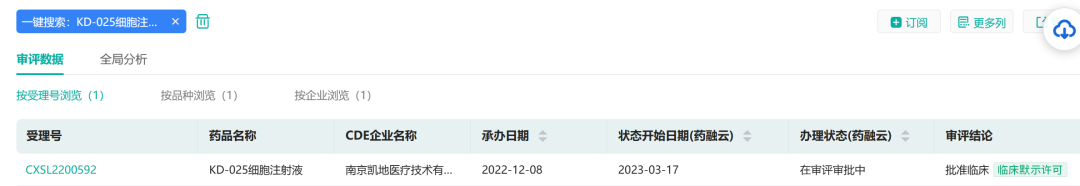
3月17日,凯地医疗自主研发的1类生物制品KD-025细胞注射液,临床试验申请(IND)通过国家药品监督管理局药品审评中心(CDE)临床默示许可,为国内首个获批靶向NKG2DL的CAR-T细胞疗法产品。
截图来源:药融云中国药品审评数据库
06.永泰生物
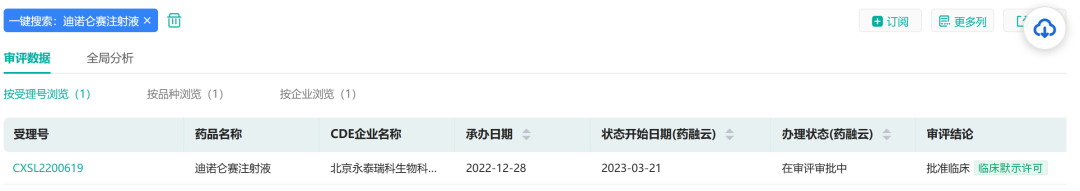
北京永泰瑞科生物科技有限公司提交的CAR-T细胞疗法产品“迪诺仑赛注射液”新药研究性(IND)申请获得国家药品监督管理局临床默示许可(受理号:CXSL2200619),适应症为:CD19阳性的复发或难治性弥漫大B细胞淋巴瘤。
截图来源:药融云中国药品审评数据库
这是一款经基因改造表达抗CD19嵌合抗原受体与拮抗TGF-β下游信号通路蛋白的T细胞治疗产品。
07.上海细胞治疗集团
3月24日,据药融云中国药品审评数据库显示,上海细胞治疗集团的自分泌PD1抗体靶向间皮素嵌合抗原受体T细胞注射液获得临床试验默示许可,适应症为间皮素阳性的晚期恶性实体肿瘤。

截图来源:药融云中国药品审评数据库
这是一款靶向间皮素的自分泌纳米抗体CAR-T细胞疗法产品(anti-PD1 MSLN-CAR-T),也是首款获批IND的自分泌纳米抗体CAR-T细胞疗法。
参考资料:
[1] 各公司官网
[2] 药融云数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论