
肝癌即起源于肝脏的恶性肿瘤,是全球常见的恶性肿瘤之一,居恶性肿瘤发病顺位的第6位,据GLOBOCAN 2020估算,2020年全球肝癌新发病例数为90.6万例,肝癌预后差,居全球常见恶性肿瘤死因第3位,2020年全球肝癌死亡数为83.0万例[1]。
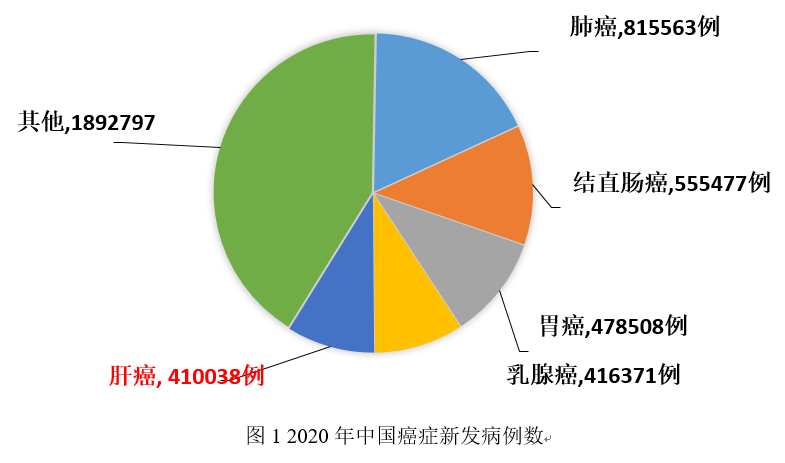
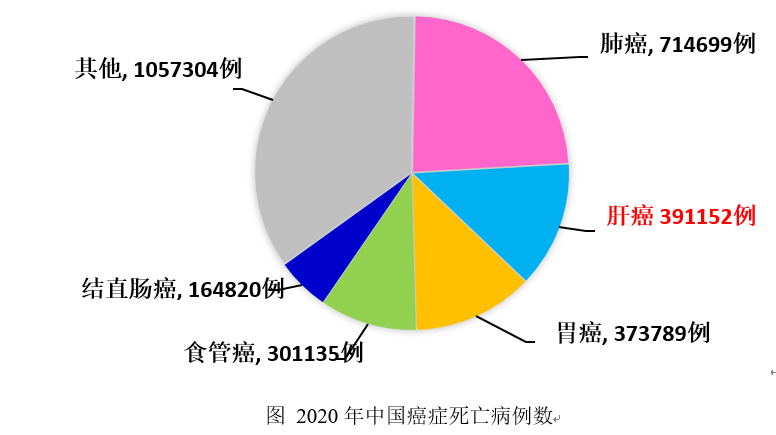
肝癌也是我国常见恶性肿瘤之一,2020年肝癌居我国恶性肿瘤发病顺位第5位,全国2020年新发肝癌病例数为40.0万人,占中国癌症新发病例数9%;2020年肝癌居我国恶性肿瘤死亡顺位第2位,全国2020年死亡肝癌病例数为39.1万人,占中国癌症死亡病例数13%[1]。
肝癌根据其病理类型可分为肝细胞癌(HCC)、胆管细胞癌以及混合性肝细胞癌和胆管细胞癌,其中HCC是肝癌最常见的病理类型,占全球所有原发性肝癌的75%~85%,在中国,HCC占所有原发性肝癌的93.0%[2]。
肝癌易复发和转移,手术治疗效果欠佳,也缺乏有效的治疗药物,临床上迫切需要开发具有高效低毒的新型药物。因而研究与开发肝癌特异性靶点药物在我国更加具有重要的意义。本文对近两年肝癌药物研发的潜力靶点进行了归纳。
1.DDR1
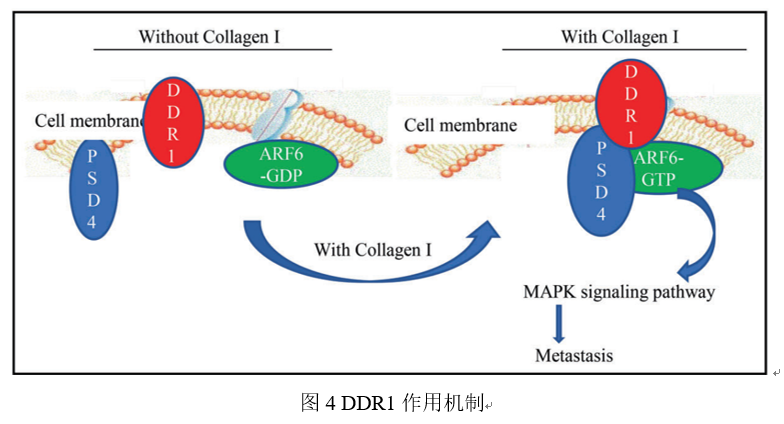
盘状结构域受体1(DDR1)在肝细胞癌组织中表达上调,且在TNM肿瘤分期系统中II-IV期的肝细胞癌组织中的表达高于在TNM肿瘤分期系统中I期的肝细胞癌组织中的表达,且DDR1的高表达与预后不良有关。DDR1靶基因参与了肝细胞癌的转移,DDR1与ARF6相互作用,通过募集PSD4激活ARF6,ARF6的激活及其在肿瘤转移中的作用离不开DDR1的激酶活性。PSD4高表达与肝细胞癌预后不良相关,DDR1通过胶原蛋白诱导的DDR1信号介导的PSD4/ARF6信号促进HCC的转移,提示DDR1和ARF6可能作为新的转移性肝癌预后标志物和治疗靶点[3]。
2.SSH3
丝切蛋白磷酸酶3(SSH3)在肝癌组织中的表达显著高于邻近肝组织,在体外细胞系中也存在同样的趋势,表明SSH3在肝癌的发生中起着极其重要的作用。同时发现SSH3在肝细胞癌患者中的过表达与病理分期和肿瘤大小呈正相关。肿瘤细胞可以通过过表达FGF改变自身和细胞外基质,而FGF/FGFR通路的激活与肿瘤细胞的增殖和凋亡密切相关。SSH3可通过FGF/FGFR途径诱导肝肿瘤细胞微环境的改变,从而导致肝癌的进一步恶性进展。SSH3下调后,肝癌细胞中FGF/FGFR通路相关基因FGF1、FGFR1和FGFR2的蛋白表达显著降低。SSH3能够加速肝癌的恶性进展,可能成为肝癌治疗的新靶点[4]。
3.CBX6
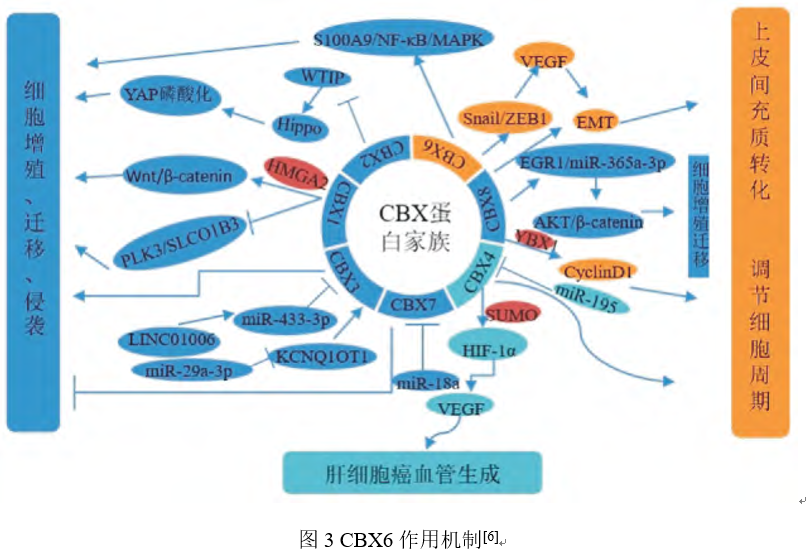
Zheng等发现染色质结合蛋白6(CBX6)在肝癌细胞系中被介导,多功能分析提示,HCC中CBX6表达升高是一个独立的不良预后因素,CBX6在体内外均可使肝癌细胞显著生长。Wang等研究发现CBX6在HCC组织中的表达显著高于旁组织。CBX6过表达的HCC患者的肿瘤生长速度快、侵袭能力强、临床分期高。进一步研究表明,CBX6通过调控转录因子Snail/ZEB1介导的上皮细胞-间充质转化(EMT)机制增强肝癌细胞的侵袭和转移能力。综上,CBX6在肝癌的发生、发展中起重要作用,可作为HCC的新型预后生物标志物和治疗靶点[5]。
4.SRD5A3
公开的数据显示,甾体5α-还原酶3(SRD5A3)在肝癌组织中的表达普遍高于非肝癌肝组织和相应的邻近肝组织。较高的SRD5A3水平预示着肝癌患者总体生存率、无进展生存率、无复发生存率和疾病特异性生存率较差,SRD5A3的缺失抑制了肝癌的生长,提示SRD5A3可能是HCC预后的潜在生物标志物和治疗靶点[7]。
5.MTMR14
肌小管蛋白相关蛋白14(MTMR14)在肝癌组织中过表达,并与临床分期呈正相关,MTMR14基因敲除促进了细胞凋亡,抑制了细胞迁移。MTMR14基因敲除也能抑制肝癌的体内转移,抑制MTMR14表达导致N-cadherin和E-cadherin下调,并促进caspase12、caspase9和caspase3的激活,抑制MTMR14是通过线粒体途径而非死亡受体途径诱发细胞凋亡。MTMR14有望成为肝癌诊断和治疗靶点[7]。
6.ID1
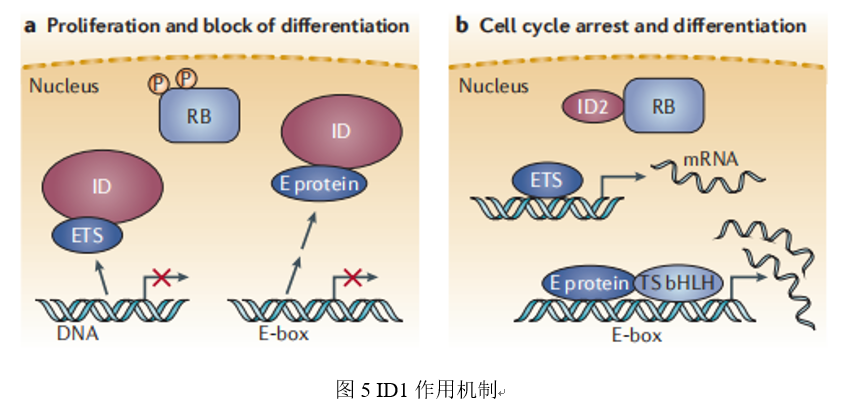
分化抑制因子1(ID1)蛋白在肝细胞癌中表达上调,并与肝细胞癌患者的肿瘤复发和不良生存密切相关。ID1诱导AURKA上调,增加的AURKA表达随后增强了MYC癌基因的转录水平,导致MYC致癌信号通路的扩增,ID1和AURKA的表达水平呈正相关。ID1和AURKA同时过表达的患者无复发生存率和总生存率较低。进一步的机制研究表明,新的AURKA/Myc下游信号通路介导了ID1诱导的肝癌细胞的生长、迁移、侵袭和耐药,这可能促进对肝癌进展的了解,并为改进晚期肝癌的治疗策略提供新的靶点[8]。
7.LPAR6
溶血磷脂酸受体6(LPAR6)是一种G蛋白偶联受体,在细胞形态和毛发生长中发挥重要作用。LPAR6在肝癌患者中的过表达会促进肿瘤的生长,并导致较差的生存。HGF可以特异性地抑制HepG2细胞的增殖,LPAR6是HGF调控的一个关键的肝癌下游基因。研究表明,HGF通过MEK/ERK信号通路抑制HepG2细胞生长,LPAR6受NCOA3的转录调控,HGF可能通过阻断NCOA3和LPAR6的表达来抑制肝癌的增殖。LPAR6基因敲除会导致肝癌细胞系的增殖停滞,并且LPAR6过表达的肝癌患者肿瘤组织显示出更高的增殖活性。这些结果表明,LPAR6是HGF的下游靶点,可能成为潜在的肝癌药物研发的新靶点[9]。
8.PES1
pescadillo核糖体生物发生因子1(PES1)在肝细胞癌中起促进肿瘤的作用,PES1蛋白表达与肝癌患者的临床特征和较短的生存期呈正相关,PES1基因敲除在体外抑制了肝癌细胞的增殖,在体内抑制了肿瘤的生长,PES1可能通过调节PI3K/AKT/GSK3β/CyclinD1信号通路中的关键蛋白来调控肝癌的增殖和肿瘤发生。PES1在调节肝细胞癌的增殖和肿瘤发生中具有新的作用,因此可能成为治疗肝癌的潜在靶点[10]。
9.UCK2
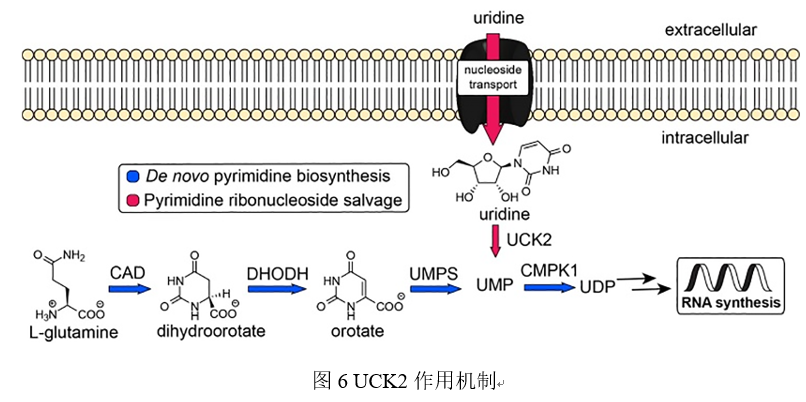
尿苷-胞苷激酶2(UCK2)是能将尿苷和胞苷磷酸化成一磷酸尿苷(UMP)和一磷酸胞苷(CMP)的嘧啶核苷激酶,是嘧啶核苷酸补救合成途径中的限速酶。最近的研究表明,UCK2在肝细胞癌组织中过表达并且与肝细胞癌的预后不良有关,UCK2促进了肝癌细胞的增殖和转移。UCK2与EGFR相互作用,阻断EGF诱导的EGFR泛素化和降解,从而导致肝癌细胞中EGFR-AKT通路的激活和转移的增强,提示UCK2可能成为治疗肝癌的潜在靶点[11]。
10.TCP1
肝癌组织中TCP1表达量显著高于正常肝组织,患者总体生存率显著低于正常组,这说明肝癌中TCP1表达量与预后不良存在一定相关性,TCP1能够与P53相互作用抑制P53的活性从而激活Wnt7b/β-catein信号通路促进肝癌细胞的增殖和迁移,这提示TCP1在肿瘤增殖转移中发挥重要作用,可能是肝癌潜在的治疗靶点[7]。
11.NUPR1
与邻近正常组织相比,核蛋白1(NUPR1)在肝细胞癌组织中显著过表达,NUPR1通过直接与相应的启动子区域结合诱导血小板衍生生长因子A(PDGFA)的转录,诱导内皮细胞血管生成,抑制PDGFA信号通路则可以破坏人脐静脉内皮细胞(HUVECs)的血管生成。NUPR1可能是肝癌潜在的治疗靶点[7]。
12.CCT3
含TCP1亚基3的伴侣蛋白(CCT3)与Yes相关蛋白(YAP)和转录因子CP2相互作用,CCT3在肝癌中高表达,与总生存率较差相关,抑制CCT3可抑制肝癌细胞的转化,CCT3可能是肝癌潜在的治疗靶点和生物标志物[7]。

13.SPIN1
肝细胞癌组织中SPIN1表达阳性,在临床肝细胞癌组织中高表达,且与肝细胞癌的恶性程度呈正相关。SPIN1可以通过增加肝癌细胞内甘油三酯、胆固醇和脂滴来调节异常的脂代谢,从而显著促进肝癌细胞的增殖。机制上,SPIN1上调肝癌细胞中FASN的表达。SPIN1通过与SREBP1c相互作用共同激活FASN启动子中的转录因子SREBP1c。此外,SPIN1在体内外均能促进肝癌的生长,并能增加小鼠肿瘤组织中甘油三酯、胆固醇和脂滴的水平。SPIN1通过SREBP1c触发的FASN信号调节异常的脂代谢,促进肝癌的生长。在治疗方面,SPIN1可能成为肝癌治疗的新靶点[13]。
14.TMOD3
原肌球调节蛋白3(TMOD3)在肝癌细胞和组织中的表达升高。在体外实验中,TMOD3基因的敲除抑制了肝癌细胞的增殖、侵袭和迁移,而TMOD3的异位表达促进了肝癌细胞的增殖、侵袭和迁移,TMOD3过表达激活了MAPK/ERK信号通路,并增加了该通路的其他靶点,包括MMP2和MMP9的水平,TMOD3可能通过MAPK/ERK信号通路促进肝癌细胞的生长、侵袭和迁移,可能成为肝癌药物研发领域的新靶点[7]。
总结
寻找重大疾病的间接或直接治疗靶点,是研发创新药物的根本,近年来,随着对HCC病理学及分子生物学机制的研究不断深入,小分子靶向抗HCC的药物研究取得了实质性的进展,为HCC全身性治疗的提供了一种有效选择。
今年肝癌药物研发领域相关资讯:
参考资料及文献:
[1]CANCER TODAY官网:https://gco.iarc.fr/today/home
[2]赫捷, 陈万青, 沈洪兵, 等. 中国人群肝癌筛查指南(2022, 北京)[J]. 临床肝胆病杂志, 2022, 38(8): 1739-1758.
[3]Zhang X, Hu Y, Pan Y, et al. DDR1 promotes hepatocellular carcinoma metastasis through recruiting PSD4 to ARF6[J]. Oncogene, 2022, 41(12): 1821-1834.
[4]Shi Q S, Zhang Y H, Long J, et al. SSH3 promotes malignant progression of HCC by activating FGF1-mediated FGF/FGFR pathway[J]. European Review for Medical and Pharmacological Sciences, 2020, 24(22): 11561-11568.
[5]Wang J, He H, Jiang Q, et al. CBX6 promotes HCC metastasis via transcription factors snail/zeb1-mediated EMT mechanism[J]. OncoTargets and therapy, 2020, 13: 12489.
[6]牛荣婷,曾冬云,王静,龙勤琴,吴小勤,龙喜带.(2022).CBX家族蛋白在肝细胞癌中的研究进展.临床与实验病理学杂志(09),1094-1097.
[7]江振洲,范书生,刘家岐,俞沁玮,张陆勇.中国药物作用靶点研究新进展(Ⅰ)[J].药学进展,2022,46(06):471-494.
[8]Wu M, Zhou Y, Fei C, et al. ID1 overexpression promotes HCC progression by amplifying the AURKA/Myc signaling pathway[J]. International Journal of Oncology, 2020, 57(3): 845-857.
[9]Zheng X, Jia Y, Qiu L, et al. A potential target for liver cancer management, lysophosphatidic acid receptor 6 (LPAR6), is transcriptionally up-regulated by the NCOA3 coactivator[J]. Journal of Biological Chemistry, 2020, 295(6): 1474-1488.
[10]Wang J, Sun J, Zhang N, et al. PES1 enhances proliferation and tumorigenesis in hepatocellular carcinoma via the PI3K/AKT pathway[J]. Life Sciences, 2019, 219: 182-189.
[11]Cai J, Sun X, Guo H, et al. Non-metabolic role of UCK2 links EGFR-AKT pathway activation to metastasis enhancement in hepatocellular carcinoma[J]. Oncogenesis, 2020, 9(12): 1-14.
[12]Liu Y, Zhang X, Lin J, et al. CCT3 acts upstream of YAP and TFCP2 as a potential target and tumour biomarker in liver cancer[J]. Cell death & disease, 2019, 10(9): 1-15.
[13]Zhao M, Bu Y, Feng J, et al. SPIN1 triggers abnormal lipid metabolism and enhances tumor growth in liver cancer[J]. Cancer Letters, 2020, 470: 54-63.
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论