
01 概述
mRNA于1961年被发现,由于mRNA的不稳定性及免疫原性,商业化进展缓慢。近年来随着mRNA修饰技术与递送技术的不断成熟,其稳定性和翻译效率大幅提高,mRNA技术得以快速发展。2020年新冠疫情爆发加速了各国对于mRNA研发投入。2020年12月11日,美国FDA授权BioNTech的mRNA新冠疫苗紧急使用许可,即全球首个mRNA疫苗实现上市。
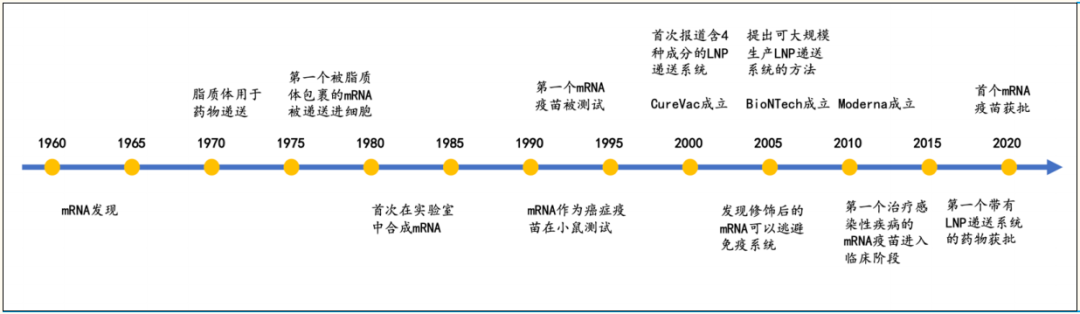
图1 mRNA发展历程
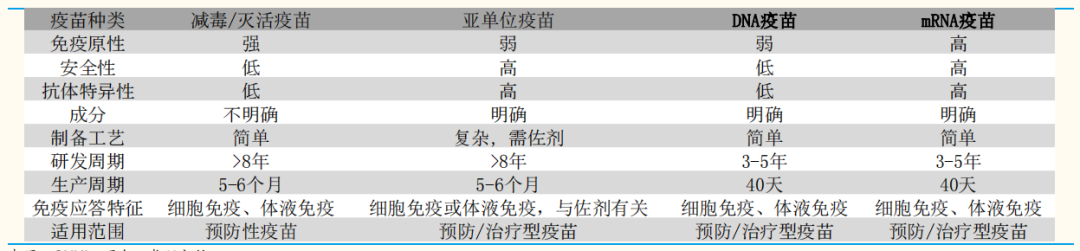
mRNA技术具备多种优势:A.可通过体外转录技术快速、经济地大规模生产mRNA,研发周期短;B.多种修饰后的mRNA更稳定,在细胞质表达(不进入细胞核),无插入突变的风险,安全性高。C.工艺适用性强,理论上任何蛋白都可以被表达。
mRNA疫苗生产不依赖细胞培养,体外转录技术能够快速、经济地大规模生产;mRNA疫苗只要掌握了病毒基因序列就可以在40天内完成疫苗样品的生产制备;整个生产过程仅涉及生物化学合成且无动物源性,因此更安全。此外,mRNA作为疫苗可以同时激活体液免疫和细胞免疫,效果显著。
表1 mRNA疫苗优势
mRNA新冠疫苗验证了mRNA技术平台在疫苗领域的适用性。除了新冠疫苗,可被广泛应用于传染病、肿瘤以及蛋白替换疗法等领域。应用mRNA疫苗技术研发新型治疗性和预防性肿瘤疫苗,也为肿瘤治疗带来了新的机会,如:Moderna的针对实体瘤的mRNA-4157与BioNTech的针对转移性黑色素瘤BNT122。
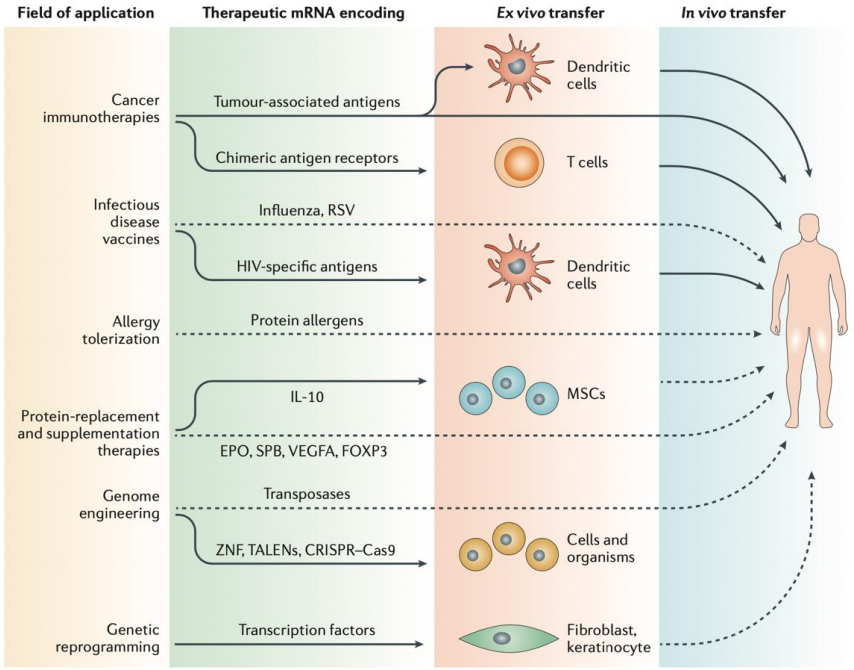
图2 mRNA应用领域
mRNA还可以用来治疗一些疾病包括罕见病。如Moderna公司用于治疗甲基丙二酸血症(MMA)的mRNA-3704和治疗丙酸血症(PropionicAcidemia,PA)的mRNA-3927等。
02 mRNA结构及工程化修饰
mRNA疫苗的结构类似于真核生物mRNA,一个单链分子在5’端有一个帽子结构(Cap),在3’端有一个PolyA尾,一个开放阅读框(ORF)两侧有一个非翻译区(UTR)。
图3 mRNA疫苗结构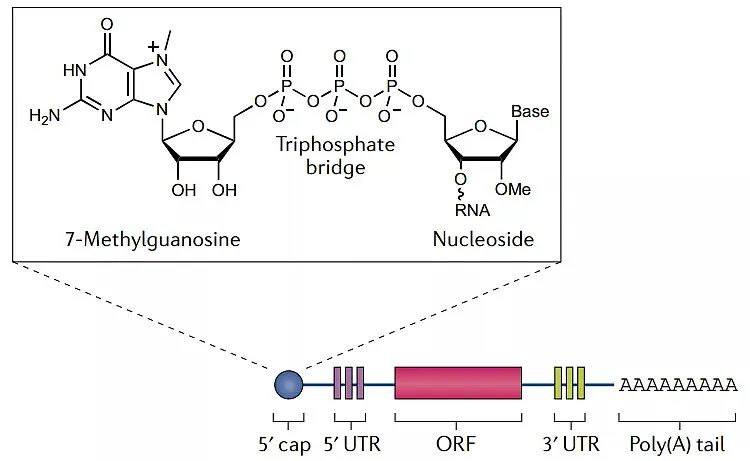

5’Cap是mRNA疫苗非常重要的结构,它与真核生物翻译起始因子(eIF4E)结合来启动翻译,另外5’Cap使其免于核酸外切酶的降解,还可促使mRAN环化形成空间及结构,增强稳定性。甲基化程度不同可形成3种类型的帽子:CAP0型、Cap1型和Cap2型。3’UTR尾部是一段Poly A序列,与帽子结构类似,PolyA尾也能起到保护mRNA防止被核酸外切酶降解的作用,PolyA也参与到翻译及其调控过程中,可与多聚腺苷酸结合蛋白(PABP)结合形成环状复合物,参与翻译的起始过程。非翻译区(UTR)影响转录调控和mRNA稳定性,这些区域强烈影响翻译效率。调节先天免疫反应的策略,如引入非天然核苷(NTPs),以及通过密码子优化提高翻译效率,也常用于mRNA疫苗。辉瑞/BioNTech的mRNA疫苗BNT162b2和Moderna的mRNA-1273利用了核苷修饰技术,用假尿苷替换尿苷。而CureVac的mRNA疫苗CVnCoV使用未经修饰的天然mRNA,通过其RNActive 平台改变mRNA序列并优化密码子,以提高mRNA的稳定性和免疫原性。
5’Cap、PolyA尾巴及编码序列两侧的5ʹ和3ʹUTR元件深刻影响mRNA的稳定性和翻译,这些都是mRNA优化设计的关键问题,通过工程化改造mRNA可大大增加其稳定性及免疫效力。

图4 疫苗工程化修饰改造
03 CMC及控制策略
mRNA疫苗或药物的生产工艺,主要分为质粒DNA原液制备、mRNA原液制备、mRNA制剂制备三个阶段。

图5 mRNA生产流程
3.1.质粒
质粒通常在重组的大肠杆菌(E.coli)中发酵生产,其纯化工艺一般包括菌体收获、裂解、菌体碎片/固体分离、层析以及澄清和浓缩等步骤,最后得到符合质量要求的质粒。
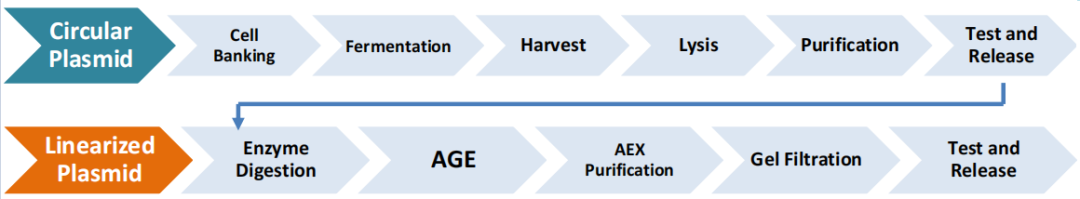
图6 质粒生产流程
3.1.1发酵
为满足商业化要求,质粒发酵通常方法是尽可能增加大肠杆菌的发酵密度,在高密度培养的发酵中,具有高氧传递速率(OTR)的生物反应器对质粒生产具有重要意义,如溶氧不足不仅可降低质粒产量,还可导致质粒结构的不稳定性,导致开环、聚集体比例提高,这为后续纯化带来很大困难。发酵溶氧等因素优化后质粒产量可达摇瓶的10-50倍。
3.1.2裂解
一般采用碱裂解方式,裂解时间为该步骤的关键控制参数,裂解时间过长会导致质粒降解降低质粒超螺旋比例,裂解时间过短降低质粒回收率。大肠杆菌裂解释放大量RNA、gDNA片段、蛋白、内毒素及质粒变体。一些分子与质粒DNA的比较相似,使得纯化变得困难。色谱法是大规模纯化质粒DNA常用方法,亲和层析选择性吸附提纯超螺旋DNA,开环DNA则流穿可用于分离开环及线性质粒;阴离子交换层析去除细菌内毒素、HCP等痕量杂质;体积排阻色谱可去除RNA、HCP、HCD小分子的杂质;为提高纯化效果常采用RNase将高分子量RNA降解为寡核苷酸。质粒纯化中对内毒素残留的去除也是工艺关注的主要问题之一。
3.1.3线性化
由于RNA聚合酶具有很高的持续合成能力,环状质粒模板转录产生不同种类长片段RNA转录子的产量比线性质粒模板高,因此,质粒的彻底线性化和纯化对于有效合成特定长度的mRNA非常重要。
3.1.4 控制策略
质粒构建及工程菌应按2020版中国药典相关规定或与国际通行要求建立种子库系统,并提供国家药品检定机构相应检定报告。种子库应保证无外源因子污染及目的基因序列和其他元件的准确性,需开展包括细菌形态学、培养物纯度、质粒限制酶切图谱、目的基因和其他元件测序、工程菌活性、质粒保有率、鉴别、抗生素抗性等检定。需开展种子库遗传稳定性分析(序列大小、序列准确性、质粒限制酶切图谱、质粒拷贝数)并明确各级种子库的限定传代代次及依据,如质粒模板中的PolyA常随大肠杆菌传代而丢失,因此在源头上控制质粒模板的质量对mRNA疫苗的效果非常重要。超螺旋比例是质粒的关键质量属性,开环的质粒可能会导致下游IVT反应提前终止,产生小片段的mRNA。需要注意的是质粒中的内毒素残留会影响IVT反应中mRNA的完整性。
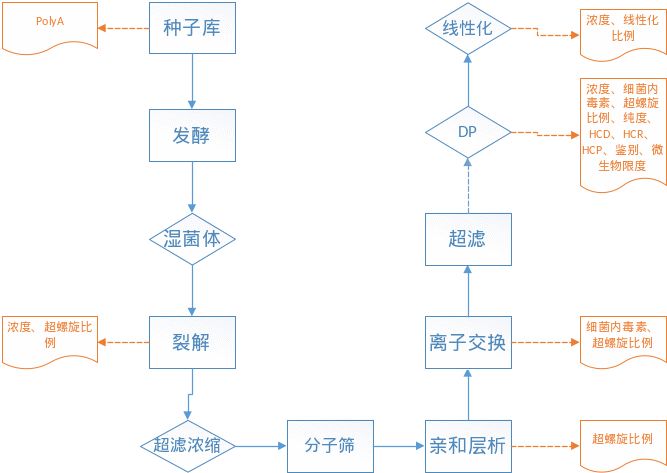
图7 质粒工艺及控制策略
3.2.mRNA原液
mRNA制备工艺通常采用转录模板进行mRNA体外转录、mRNA加帽、去磷酸化、DNA酶处理、mRNA纯化等步骤获得mRNA原液。
3.2.1IVT反应
以线性化质粒为模板在T7、T3或SP6RNA等聚合酶的作用下转录成初级mRNA,该反应只需要几个小时,通常,每毫升反应可获得毫克级的初始mRNA。T7、T3RNA等聚合酶中核酸酶残留会影响mRNA产率;另外,线性化质粒及RNA聚合酶及线性化质粒中内毒素残留会影响mRNA的完整性,需加以控制。
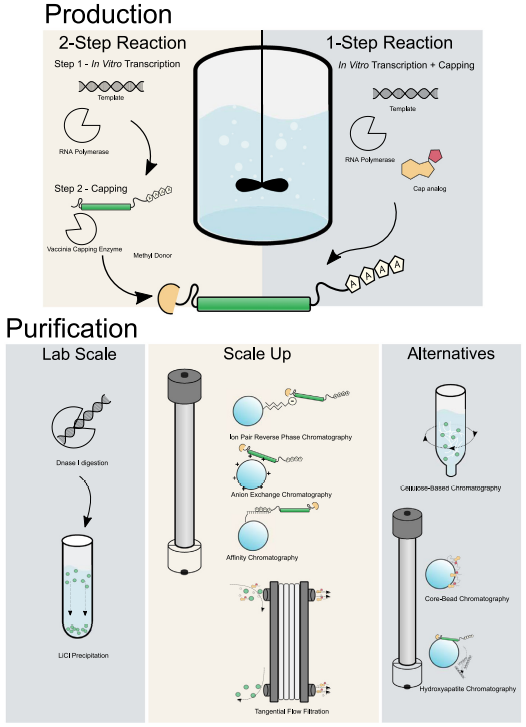
图8 mRNA原液生产工艺
初始mRNA加帽,可以在转录反应期间通过使用Cap类似物替代三磷酸鸟苷(GTP)底物来实现,称为共转录加帽。基于化学合成工艺的发展,帽类似物的结构已经从最开始第一代的mCap逐步发展到第二代的ARCA和第三代Cap1类似物(CleanCap®),第三代Cap1类似物(CleanCap®)共转录直接生成Cap1结构的mRNA,1μg起始模板量大约转录产生80-100μgmRNA,加帽效率提高到90%以上。帽类似物的质量、酶活和反应体系是影响共转录加帽法加帽效率的几大关键因素,如帽子类似物的纯度及盐型、金属残留、内毒素残留会影响mRNA的产率、加帽率及完整性;反应体系中NTP盐型及浓度对mRNA产率、完整行及dsRNA残留。
除了共转录加帽意外,还可以使用以牛痘加帽酶(VCC)和甲基供体作为底物的酶反应来进行转录后加帽(图8)。尽管牛痘病毒加帽系统被广泛的应用且存在诸多优点,但是在mRNA的扩大生产中,由于牛痘病毒加帽酶价格昂贵,并且酶用量比重大,这导致了成本的增加。与此同时,由于引入额外的蛋白和S-腺苷甲硫氨酸(SAM),使得工艺变得更加繁琐,增加了QC等质检项,因此共转录加帽也逐渐成为mRNA生产的主要方法。
3.2.2纯化
上游产生的mRNA需通过多个纯化步骤从反应混合物中分离和纯化,以达到临床质量要求。反应混合物不仅包含所需mRNA,还包含许多杂质,如酶、残余NTP和DNA模板,以及转录期间形成的异常mRNA(如dsmRNA)。
色谱是制药行业广泛使用的一种纯化方法,离子交换色谱法(IEC)可用于大规模纯化mRNA,弱阴离子交换色谱法已成功用于mRNA的纯化。然而,这种色谱必须在变性条件下进行,使得该工艺需严格控制温度。
OligdT亲和色谱可与mRNA中存在的polyA尾部结合,常用于捕获mRNA并获得高纯度产品,且可规模化纯化生产,但存在结合能力低和低成效的缺点。切向流过滤(TFF)浓缩可以去除小分子杂质,这依赖于DNA酶消化去除质粒模板,质粒模板去除也可以通过羟基磷灰石法或疏水色谱法(HIC)实现。
3.2.3控制策略
应对mRNA的体外转录、加PolyA尾、加帽、去磷酸化、DNA酶处理等工艺步骤的关键工艺参数进行研究与优化,对关键工艺参数及其控制范围进行确认,如RNA聚合酶浓度、NTP浓度、转录时间、温度、终止反应条件等;DNA酶处理工艺需考察DNA酶浓度、处理时间、温度、终止反应条件等。加帽工艺中应研究RNA浓度、温度、时间、投料比(如帽类似物、核糖核酸酶抑制剂等)、补料方式、反应温度、时间等。
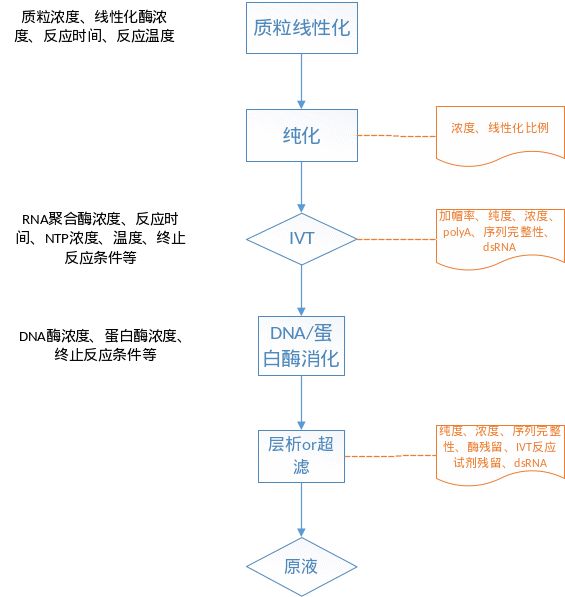
图9 mRNA原液工艺及控制策略
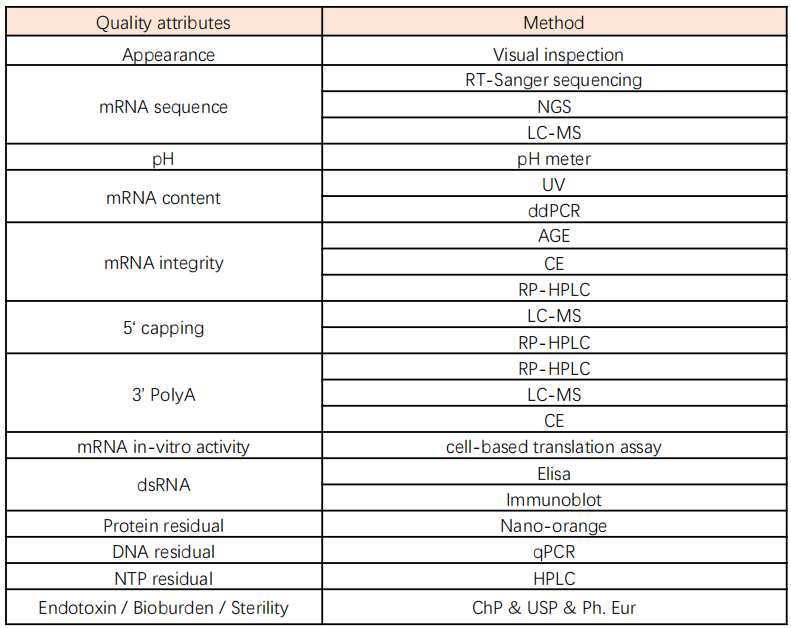
需对mRNA纯化工艺建立相应的过程控制,包括纯化产物检测,如mRNA浓度、mRNA序列准确性及完整性、产品及工艺相关杂质去除率等。需对上述工艺步骤产物进行过程控制检测,如加帽率、加PolyA尾产物长度、mRNA序列完整性、序列准确性、纯度、mRNA浓度、副反应产物浓度(不完整mRNA、双链RNA、截短RNA、长链RNA等)、残留蛋白、残留DNA、无菌、内毒素等。mRNA原液质控及检测方法如下:
表2 mRNA原液质控及检测方法
3.3.mRNA成品
3.3.1纳米脂质体颗粒
当前主流的微流控混合技术mRNA溶于偏酸性水相,脂质体溶于乙醇,通过高压对冲使mRNA溶液与脂质体溶液各组分充分混合,随着乙醇相被稀释、溶液pH变化,形成包裹mRNA的脂质纳米颗粒,其直径约100nm。Moderna公布的脂质成分包括可电离阳离子磷脂:中性辅助磷脂:胆固醇:PEG修饰磷脂,摩尔比为50:10:38.5:1.5(结构如下图),带负电荷的mRNA与带正电荷的阳离子脂质体形成复合物,脂质的疏水端向外与辅助脂质疏水端结合,形成稳定的脂质双分子层结构。
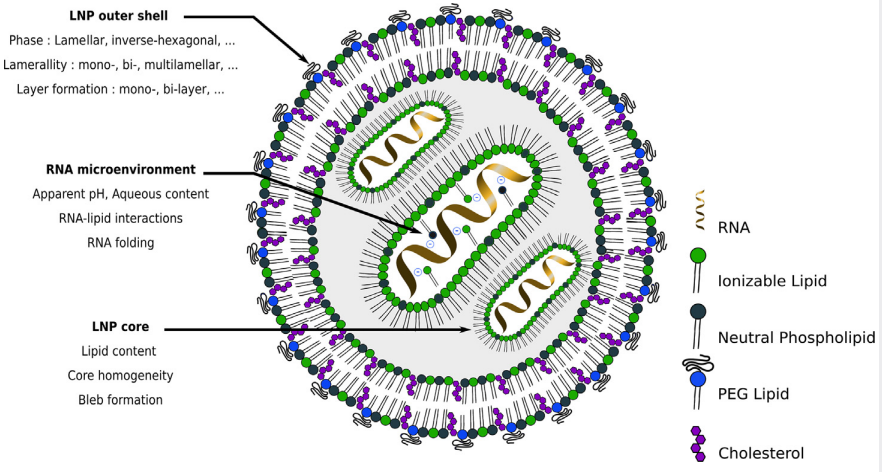
图10 纳米脂质体结构
mRNA包封后需要纯化去除未包封/装载的mRNA、游离的聚合物或脂质材料,并调整最终复合物浓度、置换溶剂缓冲体系、调节pH值等,此步骤通常通过超滤/切向流过滤实现,mRNA-LNP复合物被截留,杂质及溶剂被洗滤。
3.3.2控制策略
纳米脂质体颗粒形成阶段的关键工艺参数可能包括mRNA浓度、递送材料(尤其是阳离子材料)浓度、混合时的溶剂系统及流速、混合压力、纯化参数和除菌过滤等。需关注工艺过程纳米颗粒形态、mRNA泄露、mRNA完整性以及稳定性,并关注核酸/脂质比、电位等与mRNA稳定性以及转染效率、表达效率之间的关系。
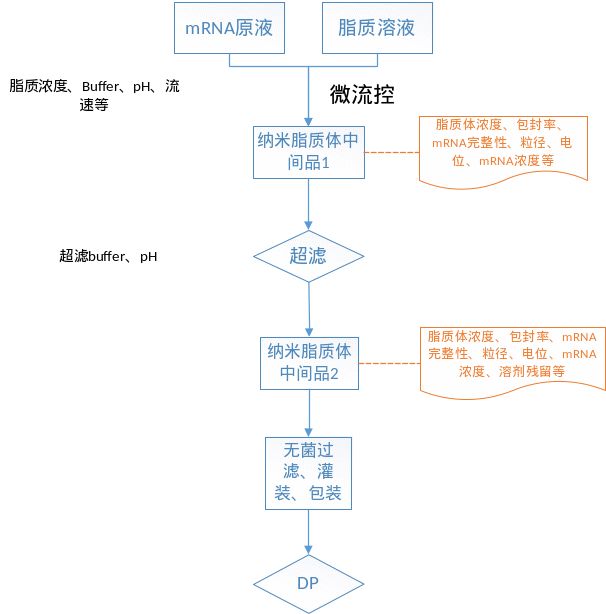
图11 mRNA成品工艺及控制策略
另外,需对脂质纳米颗粒涉及的关键原材料/辅料(脂质、阳离子聚合物等)进行充分的筛选和质控,包括原材料/辅料合成产生的杂质、稳定性试验产生的杂质、不饱和脂肪酸氧化产生的杂质等等。纳米颗粒聚集产生的颗粒物也是潜在杂质,未组装的脂质分子、阳离子物质、游离mRNA。其中,未组装的脂质分子会影响LNP的稳定性;游离mRNA易降解,同时也可能引起非特异免疫刺激,影响产品的安全有效性。
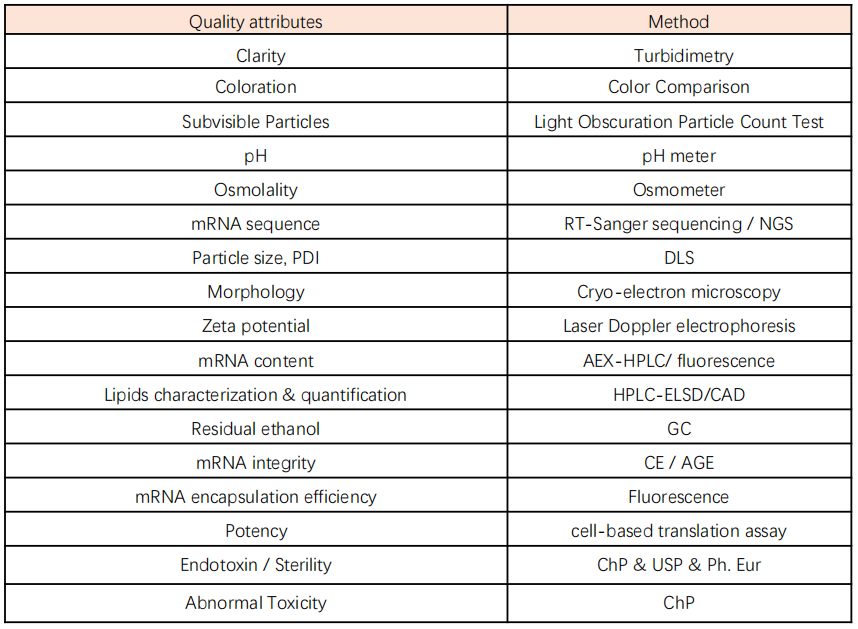
纳米颗粒质控方面应设置适宜的控制标准,如mRNA含量、包封率、Zeta电位、粒度大小及分布和辅料组分含量及试剂残留等项目,如下:
表3 mRNA成品质控及检测方法
04 小结
mRNA疫苗或药物的创新程度较高、成分复杂、生产及制剂工艺难度较大,工艺过程包含环状质粒生产,线性化质粒生产,mRNA体外转录和LNP制剂制备。质粒作为mRNA生产的关键原材料,其产品质量对mRNA体外转录影响较大,特别是内毒素残留及线性化效率。IVT反应体系复杂,其产物中不仅含有所需的目标mRNA,还含有一些杂质,包括酶、残留的NTPs、DNA模板、dsRNA和短截RNA,这些杂质会降低翻译效率,并具有免疫原性(特别是dsRNA),因而开发完备高效的工业级分离纯化工艺是挑战之一。另外mRNA产品的质量控制,如加帽率、polyA长度及分布、脂质体含量、mRNA完整性及产品相关杂质表征,也十分具有挑战性。
面对mRNA疫苗或药物的工艺及质控的难点和挑战,研发生产人员希望有成熟的工艺解决方案以及实际应用案例。在mRNA疫苗研发的战疫赛道中,金斯瑞蓬勃生物凭借其针对polyA质粒的特殊工艺平台、中国领先的线性化质粒平台、mRNA体外转录平台及LNP-mRNA生产平台等,以及多个临床质粒生产经验,为全球客户提供mRNA疫苗临床用GMP质粒生产。目前已经与国内多个mRNA疫苗企业建立合作,以及与韩国和美国公司合作的mRNA疫苗项目也相继获得临床批件。截止到2022年9月,金斯瑞蓬勃生物支持了11个来自美国、韩国、中国的客户的mRNA IND项目的申报。
凭借强大的质粒工艺开发和制造能力,金斯瑞蓬勃生物迅速建立了在mRNA领域高质量服务,为核酸药物客户提供从质粒到mRNA整体解决方案,包括环状质粒,线性化质粒,mRNA体外转录(IVT-mRNA)和脂质体纳米客户包封(mRNA-LNP),无菌灌装。其中,金斯瑞蓬勃生物mRNA体外转录拥有酶法加帽和共转录加帽(licensein),工艺稳定,mRNA产量高。金斯瑞蓬勃生物质粒CMC和mRNACMC之间的无缝衔接极大的保障了项目开发周期以及工艺的稳健性和产品的质量,整包管理极大缩短了项目周期(《金斯瑞蓬勃生物药研发生产一站式服务全国巡讲诚邀您的参与》)。
在9月28日上海NID2022 第二届核酸药物产业深度论坛上,金斯瑞蓬勃生物将在11:40-12:50举办mRNA服务平台发布会,进行现场战略签约,金斯瑞蓬勃生物平台研发总监Dr.Xiao Pan发表演讲《质粒到mRNA整体解决方案》,敬请关注!
参考文献:
1.Sahin U, Karikó K, Türeci Ö. mRNA-based therapeutics—developing a new class of drugs. Nat Rev Drug Discov 2014;13(10):759–80.
2.Plotkin SA, Plotkin SL. The development of vaccines: how the past led to the future. Nat Rev Microbiol 2011;9(12):889–93.
3.Drury G, Jolliffe S, Mukhopadhyay TK. Process mapping of vaccines: Understanding the limitations in current response to emerging epidemic threats. Vaccine 2019;37(17):2415–21.
4.Rauch S, Jasny E, Schmidt KE, Petsch B. New Vaccine Technologies to Combat Outbreak Situations. Front Immunol 2018;9.
5.Rappuoli R. Timeline: Vaccines. Cell 2020;183:552.
6.Pollard C, De Koker S, Saelens X, Vanham G, Grooten J. Challenges and advances towards the rational design of mRNA vaccines. Trends Mol Med 2013;19(12):705–13.
7.Sullenger BA, Nair S. From the RNA world to the clinic. Science 2016;352 (6292):1417–20.
8.Armbruster N, Jasny E, Petsch B. Advances in RNA vaccines for preventive indications: A case study of a vaccine against rabies. Vaccines 2019;7:132
9.Linares-Fernández S, Lacroix C, Exposito J-Y, Verrier B. Tailoring mRNA Vaccine to Balance Innate/Adaptive Immune Response. Trends Mol Med 2020;26(3):311–23
10.Sonenberg N, Gingras A-C. The mRNA 50 cap-binding protein eIF4E and control of cell growth. Curr Opin Cell Biol 1998;10(2):268–75.
11.Steinle H, Behring A, Schlensak C, Wendel HP, Avci-Adali M. Concise review: application of in vitro transcribed messenger RNA for cellular engineering and reprogramming: progress and challenges. Stem Cells 2017;35(1):68–79.
12.Tusup M, French LE, De Matos M, Gatfield D, Kundig T, Pascolo S. Design of in vitro Transcribed mRNA Vectors for Research and Therapy. Chim Int J Chem 2019;73(5):391–4
13.Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines—a new era in vaccinology. Nat Rev Drug Discov 2018;17(4):261–79.
14.Baronti L, Karlsson H, Marušicˇ M, Petzold K. A guide to large-scale RNA sample preparation. Anal Bioanal Chem 2018;410(14):3239–52.
15.Kwon H, Kim M, Seo Y, Moon YS, Lee HJ, Lee K, et al. Emergence of synthetic mRNA: In vitro synthesis of mRNA and its applications in regenerative medicine. Biomaterials 2018;156:172–93.
16.Ssr A , Dmfp A , Ama A , et al. mRNA vaccines manufacturing: Challenges and bottlenecks[J]. Vaccine, 2021, 39( 16):2190-2200.
17.Pascolo S. Messenger RNA-based vaccines. Expert Opin Biol Ther 2004;4 (8):1285–94.
18.Kariko K, Muramatsu H, Ludwig J, Weissman D. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acids Res 2011;39
19.Easton LE, Shibata Y, Lukavsky PJ. Rapid, nondenaturing RNA purification using weak anion-exchange fast performance liquid chromatography. RNA 2010;16(3):647–53.
21.Heartlein M, DeRosa F, Dias A, Karve S. Methods for purification of messenger rna. WO/2014/152966A1 2014.
22.Funkner A, Dorner S, Sewing S, Johannes K, Broghammer N, Ketterer T, et al. Method for producing and purifying RNA, comprising at least one step of tangential flow filtration. PCT/EP2016/062152; WO/2016/193206, 2018.
23.https://mp.weixin.qq.com/s/SUKGvgHVpnxpLkwHAvGlWg
24.Bancel S., Issa W.J., Aunins J.G., Chakraborty T. Manufacturing methods for production of RNA transcripts. WO/2014/152027; PCT/US2014/026835; US20160024547A1, 2016.
25.Von Der Mülbe F., Reidel L., Ketterer T., Gontcharova L., Bauer S., Pascolo S., et al. Method for producing rna. PCT/EP2015/000959; US10017826B2; WO/ 2016/180430A1, 2015. [109] Funkner A., Sewing S., Strobel I., Mutzke T. Method for purifying rna. WO/ 2018/096179A1, 2018.
26.【国金证券】医药行业研究:技术及应用不断突破,mRNA疫苗前景广阔.
27.GenScript Probio. Integrated Solution:From Plasmid to mRNA.
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论