
9月7日,据CDE官网,礼来的first-in-class药物替尔泊肽注射液(Tirzepatide)的上市申请获受理。据药融云不完全统计,礼来目前共有9款药品的上市申请已被CDE受理,或将在中国上市。
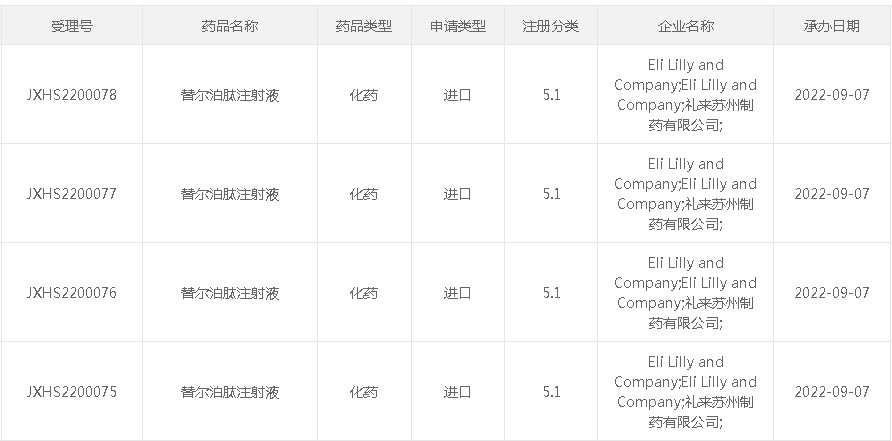
截图来源:CDE官网
在FiercePharma早前发布的2022年最值得期待的十大上市新药名单中,Tirzepatide位居第二位,2026年销售额预计将达到49亿美元。
Tirzepatide是礼来研发的GLP-1R/GIPR双靶点激动剂,最早于2022年5月13日获FDA批准上市,商品名为Mounjaro。每周注射一次,辅助饮食和运动,以改善成人2型糖尿病患者的血糖控制。Tirzepatide也是近10年来首个新糖尿病药物类型。

截图来源:药融云全球药物研发数据库
无论是作为降糖药还是减肥药,礼来Tirzepatide都被视作诺和诺德司美格鲁肽的有力对手。从此前Tirzepatide披露的价格(每月费用为974美元)来看,相较于糖尿病领域的司美格鲁肽(Ozempic)每月892美元的价格,Tirzepatide价格略高;不过相较于司美格鲁肽作为减肥药物(Wegovy)的1349美元定价,Tirzepatide则更便宜。
针对肥胖的适应症,司美格鲁肽在国内的进展较慢。9月6日,CDE官网显示,诺和诺德司美格鲁肽片的临床试验申请获默示许可,作为成人患者体重管理,用于减少热量饮食和增加体力活动的辅助治疗,初始体重指数(BMI)≥28 kg/m2(肥胖),或 ≥24 kg/m2且<28 kg/m2(超重)并且伴有至少一种与体重相关的合并疾病。而Tirzepatide早在2021年初便开始了针对超重/肥胖的iii期临床试验。

截图来源:CDE官网
除此之外,Tirzepatide还在国内布局了心血管系统疾病、NASH、睡眠呼吸暂停等适应症的研发。
Tirzepatide在国内开展登记的临床试验

截图来源:药融云中国临床试验数据库
据不完全统计,目前中国国家药品监督管理局正在办理来自礼来的18个上市申请受理号,涉及9款药品,其中偏头痛药、胰岛素类药物和抗肿瘤药物各有2款。
礼来上市申请在审药品(搜索"药融云小程序"进行相关更多数据查询)

数据来源:药融云中国药品审评数据库
礼来的高血糖素鼻用粉雾剂最早于2019年7月获FDA批准上市,用于4岁及以上糖尿病患者严重低血糖的紧急治疗,成为首个批准用于紧急治疗严重低血糖的胰高血糖素疗法,无需注射即可给药。
Galcanezumab注射液是由礼来开发的一款靶向降钙素基因相关肽(CGRP)的全人源单抗,最早于2018年9月获FDA批准上市(商品名:Emgality),用于预防性治疗成人偏头痛。2021年Galcanezumab全球销售额达5.7亿美元,同比增长59%。
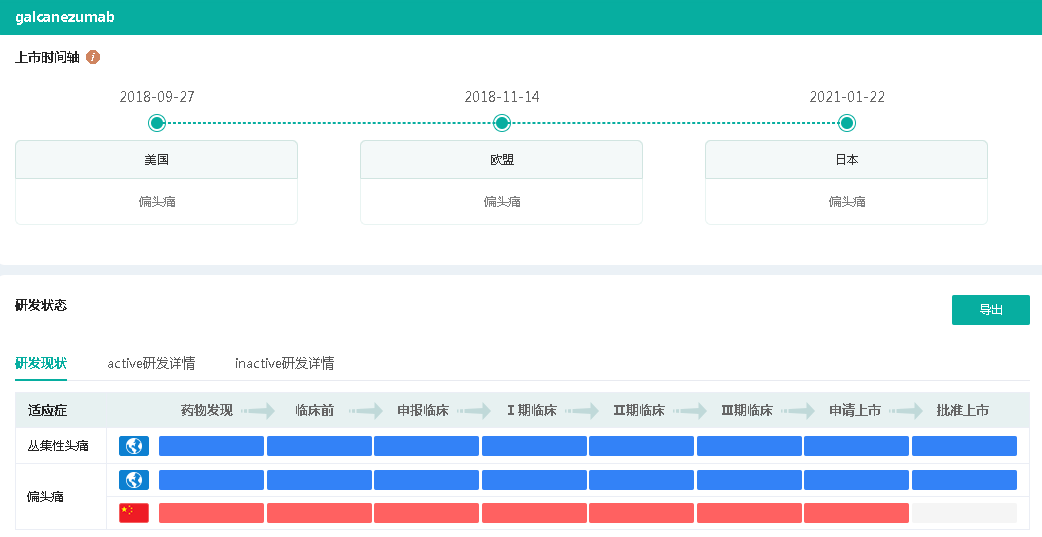
截图来源:药融云全球药物研发数据库
拉米地坦片为5-羟色胺1F受体激动剂(5-HT1F,serotonin (5-HT) 1F receptor),适用于成人有或无先兆偏头痛的急性治疗。2019年10月获得美国FDA批准,成为FDA批准的第一个5-HT1F受体激动剂。
巴瑞替尼是一款每日口服一次的JAK抑制剂,最初由Incyte开发。2009年12月,礼来与Incyte达成协议,合作开发和商业化该产品,交易总额高达7.55亿美元。2019年6月巴瑞替尼在中国首次获批上市,用于中重度活动性类风湿关节炎。目前该药已在全球多个国家获批上市,市场表现优秀,2021年全球销售额突破10亿元大关,达11.15亿美元。
Selpercatinib胶囊由礼来子公司Loxo Oncology at Lilly开发,2020年5月,selpercatinib在美国获批上市,成为首款获批用于携带RET基因变异癌症患者的精准疗法。2021年11月在中国递交上市申请获受理,并被纳入优先审评,适应症为适应症为转染重排基因融合阳性的局部晚期或转移性非小细胞肺癌患者、RET突变的需要系统性治疗的晚期或转移性甲状腺髓样癌(MTC)成人和12岁及以上儿童患者以及RET基因融合阳性的需要系统性治疗和放射性碘治疗(如适用)难治的晚期或转移性甲状腺癌成人和12岁及以上儿童患者的治疗。
雷莫西尤单抗注射液是一种人类IgG1单克隆抗体,2021年全球销售额达10亿美元。2022年3月,雷莫西尤单抗注射液在国内获批上市,用于治疗转移性胃癌,目前在审的上市申请对应的适应症为作为甲胎蛋白 (AFP)≥400ng/ml 且之前已接受过索拉非尼治疗的肝细胞癌患者的二线疗法。今年3月,信达生物与礼来达成协议,获得雷莫西尤单抗中国商业化权益。
参考来源:
[1] CDE官网
[2] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论