
据药融云统计,7月共有46款1类新药(68个受理号)获得临床默示许可(不包括进口新药,不包括补充申请),其中28款为首次获批临床(临床默示许可),包括恒瑞医药的3款新品、甘李药业的超长效胰岛素周抑制剂、君实生物的CD20/CD3双特异性抗体等。
7月首次获批临床的1类新药
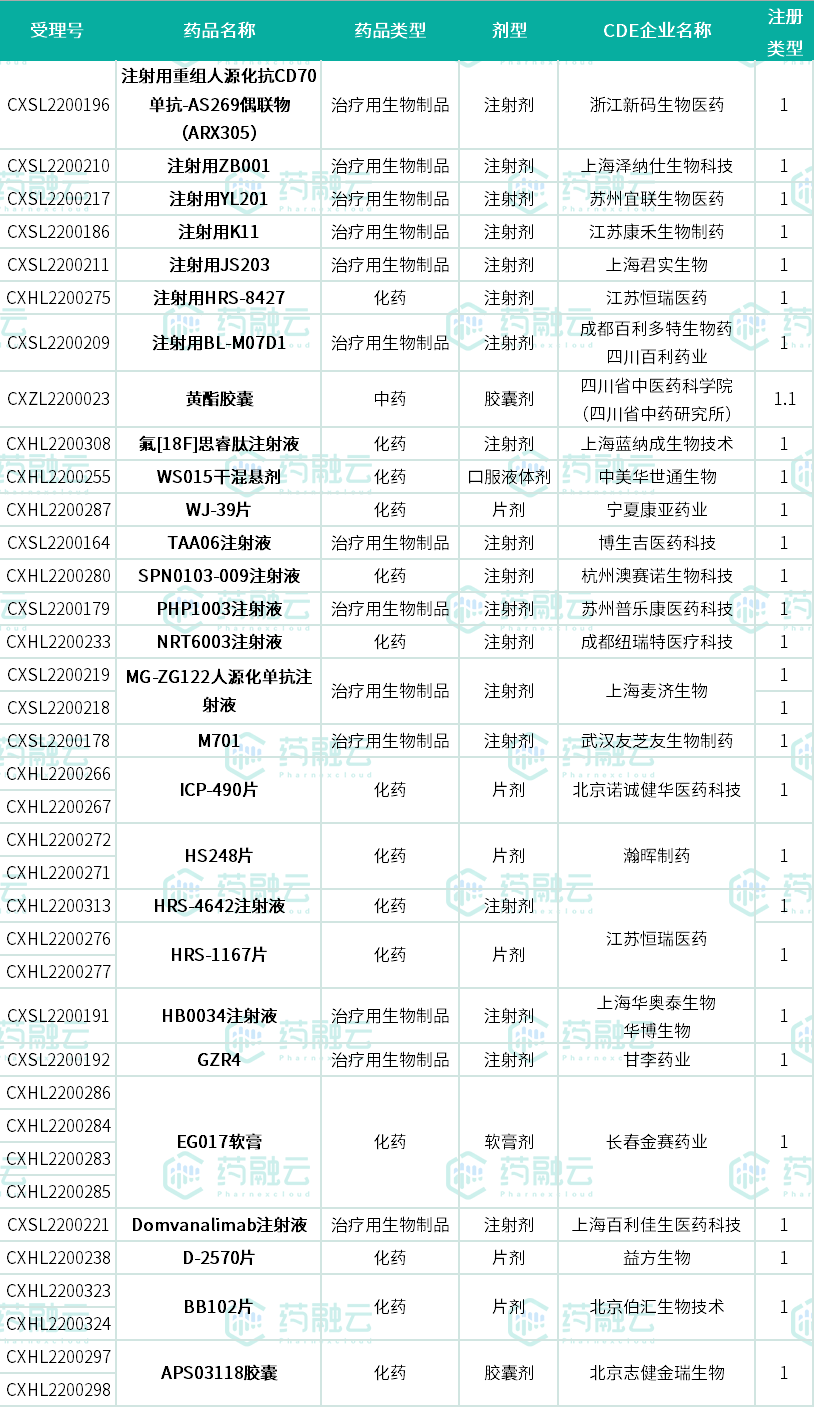
数据来源:药融云中国药品审评数据库
- 01.注射用HRS-8427——恒瑞医药
恒瑞医药的注射用HRS-8427临床申请于2022年5月5日获受理,7月底获得临床默示许可,用于尿路感染。
注射用HRS-8427通过抑制细胞壁的生物合成发挥抑菌杀菌作用,临床前显示其在多个标准菌株和临床分离菌株构建的小鼠感染模型中发挥抗菌药效,安全性良好。经查询,国内暂无同类产品获批上市。截至目前,恒瑞医药在注射用HRS-8427相关项目累计已投入研发费用约3,307万元。
- 02.HRS-4642注射液——恒瑞医药
恒瑞医药的注射用HRS-4642注射液临床申请于2022年5月20日获受理,7月底获得临床默示许可,用于KRAS G12D突变的晚期实体瘤。
- 03.HRS-1167片——恒瑞医药
恒瑞医药的注射用HRS-1167片临床申请于2022年5月6日获受理,后获得临床默示许可,同意按照提交的方案开展晚期实体肿瘤的临床试验。
HRS-1167 片可抑制肿瘤细胞增殖,发挥抗肿瘤作用。经查询,目前国内外尚无同类药品获批上市,亦无相关销售数据。截至目前,在HRS-1167 片相关项目上恒瑞医药累计已投入研发费用约 1,879 万元。
- 04.注射用JS203——君实生物
7月12日,君实生物发布公告称于近日收到国家药品监督管理局核准签发的《药物临床试验批准通知书》,注射用JS203(项目代号“JS203”)的临床试验申请获得批准。
JS203为君实生物自主研发的重组人源化抗CD20和CD3双特异性抗体,主要用于复发难治B细胞非霍奇金淋巴瘤的治疗。临床前体内药效试验显示,JS203具有显著的抑瘤效果。此外,动物对JS203的耐受性良好。
截至7月12日,全球仅有一款抗CD20和CD3双特异性抗体Lunsumio®(mosunetuzumab,罗氏制药产品)获得欧盟委员会的有条件上市许可,用于治疗先前至少接受过两种系统治疗的成年复发性或难治性(R/R)滤泡性淋巴瘤(FL)患者,国内尚无同类靶点产品获批上市。
- 05.GZR4——甘李药业
7月8日,甘李药业宣布,其自主研发的1类创新型治疗用生物制品GZR4收到国家药监局下发的《药物临床试验批准通知书》(受理号:CXSL2200192),获批适应症为糖尿病。
GZR4是中国首款由本土企业自主研发的第四代超长效胰岛素周制剂,预计通过皮下注射每周给药一次,实现一周基础血糖的平稳控制,有望降低患者的注射频率,降低注射恐惧,减轻患者身心负担。此外,该产品在提高用药依从性的同时,还有望提升患者的治疗效果,从整体上改善糖尿病患者的生活质量。
- 06.EG017软膏——长春金赛药业
EG017软膏的临床试验申请于2022 年 5 月 7日获受理,后于7月获得临床默示许可,适应症为绝经后女性干眼症。据悉,这是金赛药业申报的第一款新药。7月12日,金赛药业又递交了EG017片剂的临床试验申请。
EG017最早为是由宁波熙健研发的一种新的选择性雄激素受体调节剂(SARM)。2021年8月,金赛药业拟受让宁波熙健所拥有的EG017相关知识产权及专有权项目。EG017临床前研究结果显示,EG017对于改善压力性尿失禁和干眼症有明显的治疗作用,且EG017未来可开发适应症还包括乳腺癌、子宫内膜异位症、肥胖症和脂肪肝等。
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论