在生物界有一个特别的现象可以实现“1+1=0”。1990年,来自美国和荷兰的研究人员发现,在矮牵牛中引入外源性查尔酮合成酶(CHS)基因,预期的结果应该是这种控制色素合成的酶过表达,花朵的颜色更加鲜艳,但是恰恰相反,花朵颜色变浅,有的甚至完全变成白色,而且引入外源性CHS基因的矮牵牛其CHS水平比正常矮牵牛要低50%。这一现象在当时让人们百思不得其解。直到1998年,美国科学家CraigC . Mello和Andrew Fire在Nature发文解释了这种现象,他们利用秀丽隐杆线虫模型发现,在实验中引入外源性RNA可抑制内源基因的表达,且双链RNA(dsRNA)抑制靶基因表达的程度要明显高于单链RNA。他们把这种现象称为RNAi(RNA interference,RNA干扰),二人也因此获得了2006年的诺贝尔生理学或医学奖。

▲转基因植物中的基因沉默现象
图源:PLoS Biol(doi:10.1371/journal.pbio.0020133)
近几年,RNAi(RNA干扰)在医药界尤为火热,许多疾病的发生与基因的异常表达有关,RNAi的本质就是一种进化上高度保守的基因沉默(Gene silencing)现象。基因沉默主要分为转录前水平基因沉默(TGS)和转录后水平的基因沉默(PTGS)。TGS是指由于DNA修饰或染色体异染色质化等原因使基因不能正常转录;而PTGS则是启动了细胞质内靶向特定mRNA序列的降解机制,切断了mRNA翻译出蛋白质的过程。RNAi由双链RNA分子诱发,并导致同源mRNA高效特异性降解,是这一种转录后水平的基因沉默(PTGS)现象。
目前,小分子药物和抗体药物能有效抑制特定细胞表面、细胞内和细胞外的靶点,但是仍有一些靶点无法被这些传统的药物所攻克。针对这些靶点开发有效的药物,将填补许多疾病尚无有效治疗方案的空白。其中,RNAi疗法可特异性、高效地实现靶基因沉默,或将释放这些“不可成药”靶点的市场潜力。
RNAi疗法的作用机制如下图,起初双链RNA(dsRNA)被引入细胞,作为RNAi的触发工具。宿主细胞对这些dsRNA迅速产生反应,通过核酸内切酶Dicer将dsRNA切割为长约21-23bp的RNA片段(siRNA,小干扰RNA),随后siRNA与RNA诱导的沉默复合物(RISC)相结合,并解旋成单链,其中正义链被降解,反义链则诱导RISC与互补的mRNA相结合,并将其降解,从而导致基因沉默,靶蛋白无法合成。RNAi可以被视为一种催化过程,每一个RNAi触发工具可以降解数百次mRNA,从而实现RNAi疗法的长效作用。
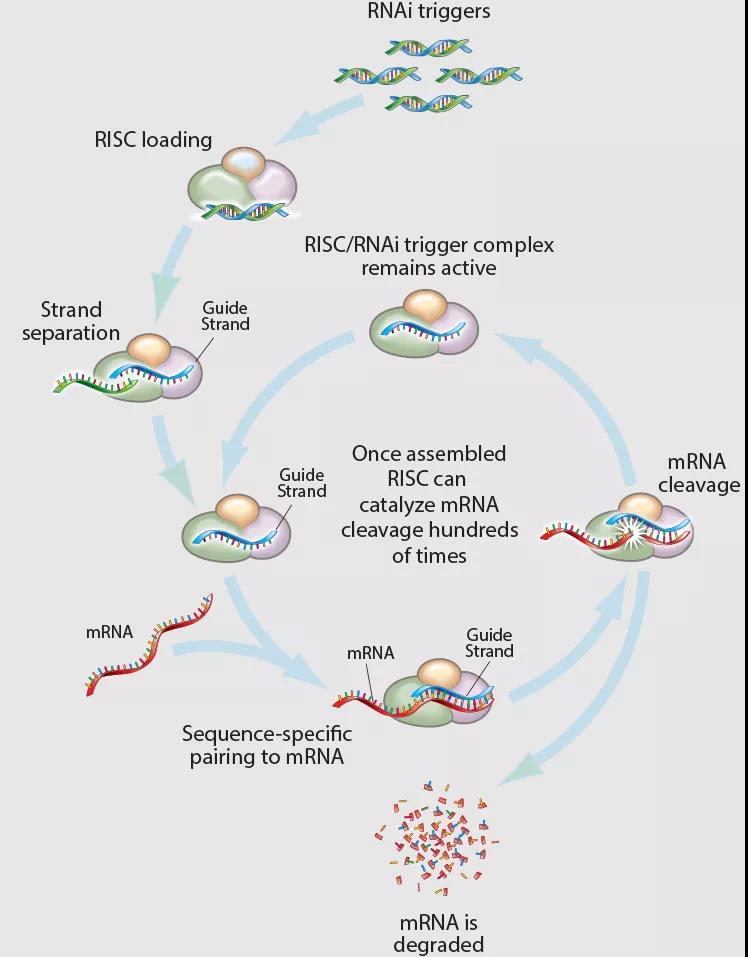
▲RNAi疗法作用机制
图源:Arrowhead Pharmaceuticals
RNAi疗法的优势:
- 使疾病相关基因“沉默”
- 有潜力靶向转录组中的任何靶点,包括过去的“不可成药”靶点
- 能快速识别靶点
- 具有高度特异性
- 有潜力在一个药物产品中针对多个RNA序列,实现多个相关靶基因的协同“沉默”
- RNAi疗法可通过靶点、细胞特异性递送以及基因下调,实现个体化用药
关于Arrowhead Pharmaceuticals
Arrowhead Pharmaceuticals是一家美国生物技术公司,成立于1989年,2004年纳斯达克上市。该公司利用基因沉默机制来开发治疗顽固性疾病的药物,使用广泛的RNA化学组合与高效的递送方式触发RNAi机制,从而快速、深入、持久地实现靶基因的下调,抑制靶蛋白的产生。

技术平台& 专利布局
Arrowhead Pharmaceuticals的RNAi技术平台称为TRiMTM(Targeted RNAi Molecule),利用配体介导的递送方式,形成结构简单的组织特异性靶向系统。实现精准靶向是Arrowhead研发工作的核心,而TRiMTM平台正是建立在公司已成熟运用十多年的靶向药物递送工具基础之上,公司的科学家利用TRiMTM平台逐步去除无关的特性和化学组分,并保持最佳的药理活性。
TRiMTM平台根据需要为每个候选药物优化了以下组件:高亲和力靶向配体、多样化的连接子和化学性质、具有强大药代动力学的结构、以及具有序列特异性稳定化学性质的高亲和力RNAi trigger。TRiMTM平台的优势有:制造流程简单、成本低;支持多种给药途径;更小的分子产生更少的代谢物,减少细胞内累积,潜在地提高了安全性。Arrowhead认为,要使RNAi发挥其真正的潜力,必须将目光扩展到肝脏以外的器官,并且Arrowhead也在利用TRiMTM平台引领这一趋势,该平台已显示出应用于多个组织的潜力,如肝脏、肺、肿瘤、肌肉等。

▲图源:Arrowhead Pharmaceuticals
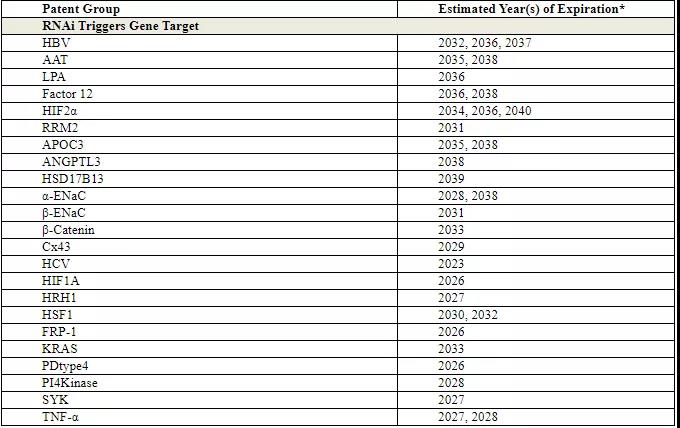
截至2020年9月,Arrowhead Pharmaceuticals拥有398项专利,其中包括250项RNAitrigger分子的专利、35项靶点基团或靶点化合物的专利以及5项流体动力学基因递送系统专利,这些专利是公司的核心资产的一部分。
RNAitrigger与靶点专利
靶向配体与RNAi递送技术专利
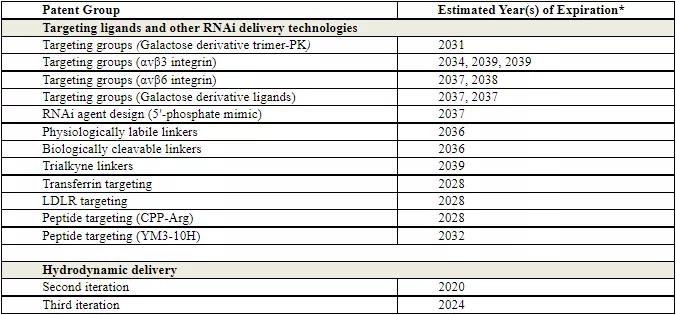
▲来源:Arrowhead Pharmaceuticals财报
研发管线
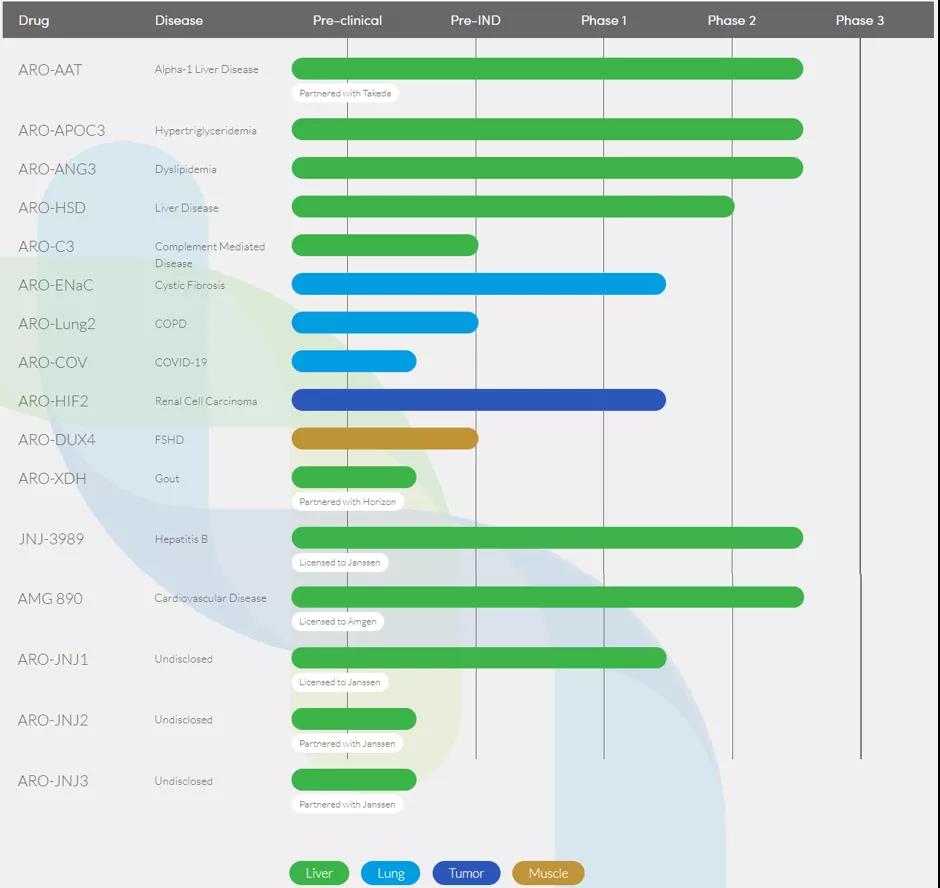
▲Pipeline概览
图源:Arrowhead Pharmaceuticals(更新至2020年6月)
Arrowhead专注于创新型药物的开发,治疗与基因异常有关的疾病,这些疾病的特点通常是一种或多种蛋白质的过表达。公司利用RNAi技术的深度与多功能性,瞄准那些过去的“不可成药”靶点,以及小分子药物和传统生物制品无法治疗的疾病。目前,公司研发管线已涉及肝脏、肺、肿瘤、肌肉等疾病领域。
肝脏
JNJ-3989(JNJ-73763989,前称ARO-HBV)是一款治疗慢性乙型肝炎的皮下注射siRNA,旨在与其他疗法相联合,沉默所有HBV基因相关产物,并干扰上游逆转录过程,利用人体的天然免疫屏障清除病毒,有望实现乙肝的功能性治愈。(目前乙肝的标准治疗方案是使用核苷酸和核苷类似物)该候选产品由Arrowhead与杨森公司合作开发,1/2a期研究及前期研究由Arrowhead进行,目前杨森针对该药开展了多项2期临床试验。
2019年8月,杨森开启了一项名为REEF-1的多中心、随机双盲、阳性对照的2b期研究(NCT03982186),该研究旨在建立JNJ-73763989+核苷(酸)类似物(NA)的抗病毒活性的剂量-反应关系,并评估JNJ-73763989+ NA(±JNJ-56136379)和JNJ-56136379+ NA联合疗法治疗慢性乙肝的疗效,该研究招募470例慢性乙肝患者,研究主要终点是观察第48周时满足NA停药标准(ALT<3x ULN、HBVDNA <LLOQ、HBeAg阴性[<LLOQ]和HBsAg<10 IU/mL)的患者比例。
2021年11月,公司在2021年美国肝病研究学会年会(AASLD2021)上披露了REEF-1研究的临床数据。截至第72周,达到主要终点的患者比例如下图,其中JNJ-73763989200mg(最高剂量)+NA组的比例最高,达到29.7%(第48周时为19.1%)。
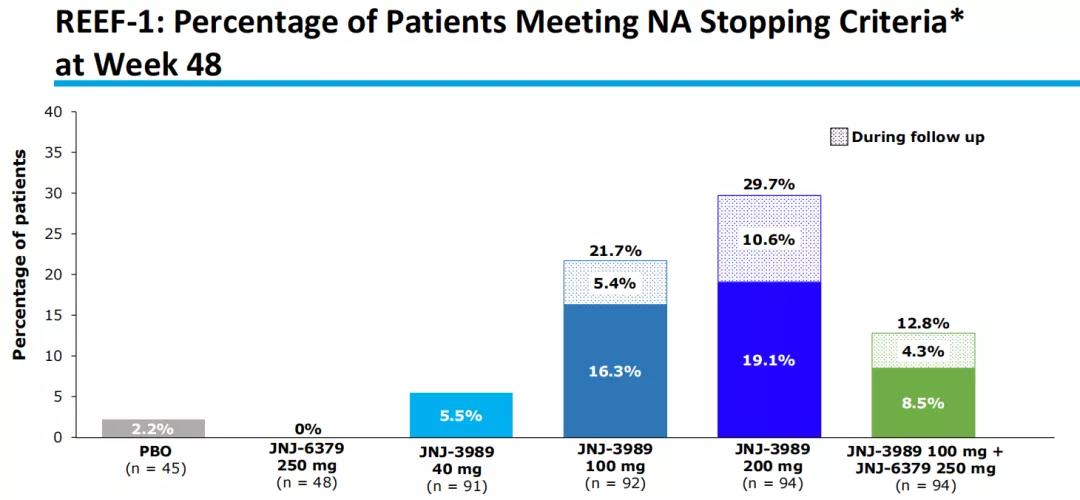
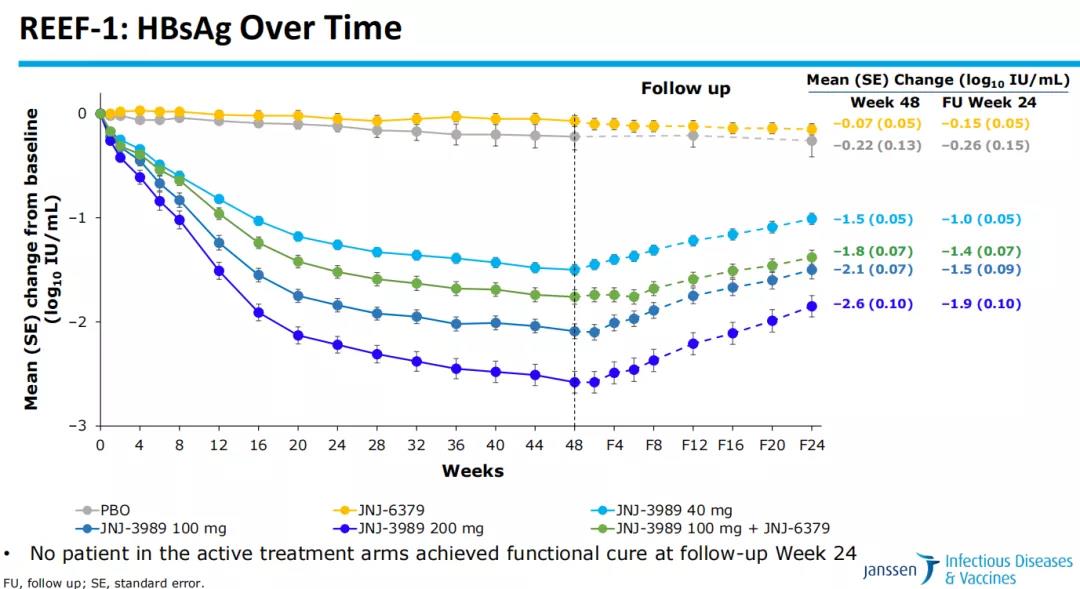
数据显示,JNJ-73763989显示出剂量依赖性反应。在JNJ-73763989200mg + NA组中,到第48周,HBsAg(乙肝表面抗原)水平平均降低2.6log10IU/mL;到第72周,HBsAg水平平均降低1.9log10IU/mL;到第48周,74.7%的患者实现HBsAg<100 IU/mL。同时,所有治疗组都显示出良好的耐受性与安全性,公司也在进行涉及不同作用机制的联合用药研究。
ARO-HSD是一款靶向HSD17B13(羟基类固醇17-β脱氢酶13)的RNAi疗法,旨在下调HSD17B13的表达,被开发用于治疗非酒精性脂肪性肝炎(NASH)。HSD17B13是一种羟基类固醇脱氢酶,参与激素、脂肪酸和胆汁的新陈代谢。人类遗传学研究表明,HSD17B13的功能丧失性突变降低了酒精性肝病与非酒精性肝病的风险。目前,公司正在开展一项1/2a期单剂量和多剂量递增研究,旨在评估ARO-HSD在健康志愿者以及NASH或疑似NASH患者中的安全性、耐受性、药代动力学和药效动力学效应。
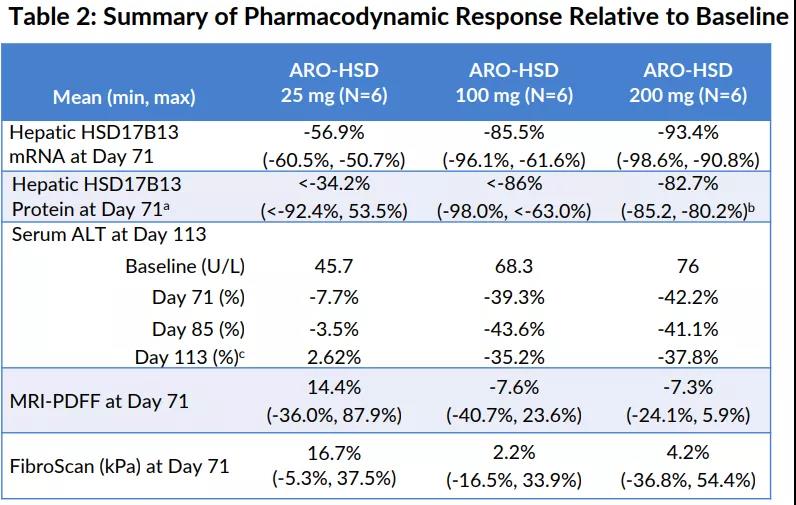
2021年11月,Arrowhead在2021年美国肝病研究学会年会(AASLD2021)上披露了ARO-HSD1/2a期研究的中期数据(数据截取至2021年8月12日)。结果显示,所有患者体内均观察到HSD17B13mRNA的剂量依赖性药效作用。在25mg、100mg、200mg剂量治疗队列中,HSD17B13mRNA分别平均减少了56.9%、85.5%、93.4%;在100mg、200mg剂量治疗队列中观察到血清谷丙转氨酶(ALT)水平显著减少;MRIPDFF检测显示,18例患者中有9例患者肝脏脂肪水平减少4~41%;FibroScan检测显示,18例患者中有6例患者肝脏硬度(kPa)降低4~37%。同时显示出良好的耐受性与安全性。
针对非酒精性脂肪性肝炎(NASH),Arrowhead与杨森公司于2021年11月17日公布,双方合作开发了候选产品JNJ-75220795,目前正处于临床1期阶段。JNJ-75220795是一款在研的siRNA药物,基于Arrowhead的TRIM™平台,旨在抑制patatin样磷脂酶域蛋白3(PNPLA3)的表达,是NASH的潜在治疗方案。遗传学与临床前验证显示,在携带I148M突变的个体中,PNPLA3是肝脏脂肪累积和损伤的驱动因素。
ARO-APOC3是一款靶向载脂蛋白C-III(ApoC-III)的RNAi疗法,被开发用于治疗严重高甘油三酯血症(SHTG)、混合性血脂异常、家族性乳糜微粒血症综合征(FCS)。FCS是一种罕见的遗传性疾病,由脂蛋白脂肪酶(LPL)功能受损引起,FCS患者可能出现严重的高甘油三酯血症(HTG)(通常超过2000mg/dL)和甘油三酯(TG)诱发的胰腺炎风险升高。
ApoC-III调节富含甘油三酯的脂蛋白(TRL),是一种已知的脂蛋白脂酶(LPL)活性和LPL介导的TRL脂肪分解抑制剂,ApoC-III还通过抑制肝细胞受体介导的摄取来延迟肝脏清除脂蛋白残留,导致血液中甘油三酯(TG)水平和极低密度脂蛋白(VLDL)水平升高、高密度脂蛋白胆固醇(HDL-C)水平降低,因此ApoC-III已成为降低甘油三酯的重要治疗靶点。ARO-APOC3旨在通过减少肝脏ApoC-III的表达,以减少极低密度脂蛋白(VLDL)的合成、加速分解富含甘油三酯的脂蛋白(TRL),更好地清除VLDL以及乳糜微粒残留(CR)。2019年6月,Arrowhead宣布该药已获得FDA授予的孤儿药资格认定,用于治疗家族性乳糜微粒血症综合征(FCS)。
▲来源:药融云数据库
2020年11月,公司在2020美国心脏协会科学年会(AHA2020)上披露了ARO-APOC3在高甘油三酯血症(HTG)以及乳糜微粒血症患者中的临床研究数据(数据截取至2020年8月31日)。数据显示,ARO-APOC3可显著且持续降低ApoC-III以及甘油三酯(TG)水平,在HTG患者中可将甘油三酯水平降低74%~92%;显著降低非高密度脂蛋白胆固醇(non-HDL-C)水平,提高高密度脂蛋白胆固醇(HDL-C)水平。


2021年11月,公司在2021美国心脏协会科学年会(AHA2021)上披露了ARO-APOC3在家族性乳糜微粒血症综合征(FCS)和多因素乳糜微粒血症(MCM,非FCS)患者中的临床研究数据(数据截取至2021年3月29日)。数据显示,在FCS与MCM(非FCS)患者中,ARO-APOC3实现了类似的关键脂质参数变化,持续降低甘油三酯(TG)水平、ApoC-III以及非高密度脂蛋白胆固醇(non-HDL-C)水平,并提高了高密度脂蛋白胆固醇(HDL-C)水平,有望实现每3个月或每6个月给药一次。在FCS患者与MCM患者中,ApoC-III水平分别降低了98%和96%;TG水平的最大降幅中位数分别为91%和90%;non-HDL-C水平分别降低了58%和49%;HDL-C水平分别增长152%和111%。
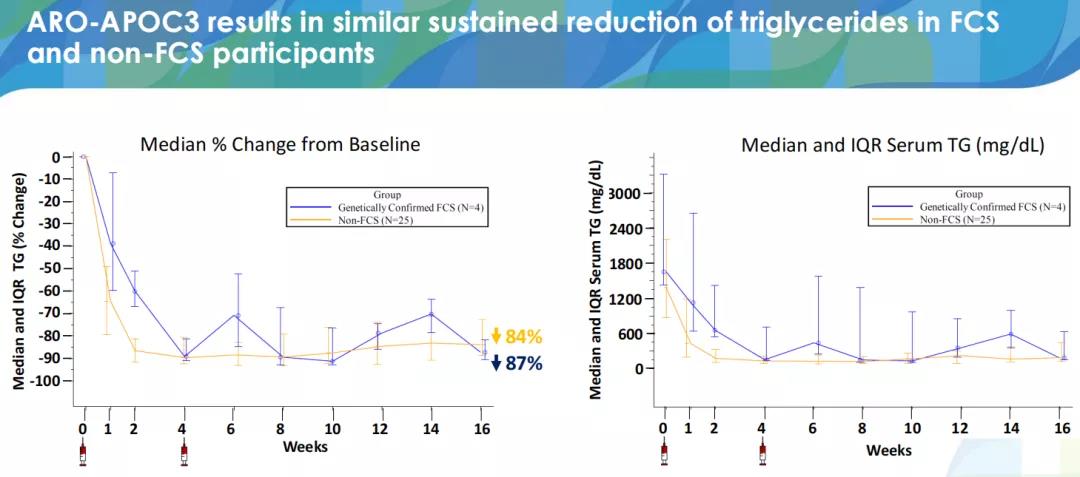
2021年6月,Arrowhead宣布开启一项随机、双盲、安慰剂对照的2b期临床试验,旨在评估ARO-APOC3在严重高甘油三酯血症(SHTG)患者中的安全性与疗效,预计主要终点完成时间为2022年7月(NCT04720534);2021年9月,Arrowhead开启了一项随机、双盲、安慰剂对照的2b期临床试验,旨在评估ARO-APOC3在混合性血脂异常患者中的安全性与疗效,预计主要终点完成时间为2023年7月(NCT04998201);公司还计划于2021年11月开启ARO-APOC3治疗家族性乳糜微粒血症综合征(FCS)的3期临床研究,预计主要终点完成时间为2023年12月(NCT05089084)。
ARO-ANG3是公司开发的一款靶向血管生成素样蛋白3(ANGPTL3)的RNAi疗法,被开发用于治疗血脂异常、家族性高胆固醇血症(FH)、高甘油三酯血症(HTG)。ANGPTL3是一种由肝脏合成的脂蛋白酯酶和内皮酯酶抑制剂,抑制ANGPTL3被证实可降低血清低密度脂蛋白(LDL)、血清和肝脏甘油三酯(TG)水平,且经遗传学验证,是心血管疾病的一个新治疗靶点。
2019年7月,Arrowhead宣布ARO-ANG3已获得FDA授予的孤儿药资格认定,用于治疗纯合子家族性高胆固醇血症(HoFH)。HoFH是一种罕见的常染色体显性遗传代谢病,其特征是低密度脂蛋白胆固醇(LDL-C)显著升高,有早发动脉粥样硬化性心血管疾病的倾向。
2020年11月,公司在2020美国心脏协会科学年会(AHA2020)上披露了ARO-ANG3在血脂异常患者中的1期研究数据(数据截取至2020年4月30日)。数据显示,在杂合子家族性高胆固醇血症(HeFH)患者中,甘油三酯(TG)水平降幅最高达到47%,低密度脂蛋白胆固醇(LDL-C)降幅最高达到35%;在非家族性高胆固醇血症(non-FH)患者中,TG水平降低42%,LDL-C水平降低32%;在高甘油三酯血症(HTG)患者中,TG水平降低75%,LDL-C水平降低5%。
2021年6月,公司宣布开启一项随机双盲、安慰剂对照的2b期临床试验,旨在评估ARO-ANG3在混合性血脂异常患者中的安全性与疗效。计划招募180名受试者,预计主要终点完成时间为2022年10月(NCT04832971)。
AMG890(即Olpasiran,前称ARO-LPA)是一款靶向载脂蛋白A(APOA)的RNAi疗法,该蛋白质是脂蛋白(a)的主要结构蛋白,在遗传水平上与心血管疾病风险增加相关,与胆固醇和低密度脂蛋白水平无关。AMG890旨在抑制载脂蛋白A的表达,用于治疗高脂蛋白血症。2016年9月,Amgen与Arrowhead达成全球合作协议,共同开发并商业化AMG890。
2020年7月,公司开启了一项随机、双盲、安慰剂对照的2期临床试验(NCT04270760),旨在评估Olpasiran(AMG890)在血浆脂蛋白(a)升高患者中的安全性、耐受性与疗效,该试验招募290名受试者,预计只要终点完成时间为2022年1月。
药融云数据www.pharnexcloud.com显示,AMG890已于2021年在国内获批临床,登记号为CTR20211425。
▲来源:药融云数据库
ARO-AAT(也称TAK-999)是Arrowhead开发的第二代皮下给药RNAi疗法,用于治疗α-1抗胰蛋白酶缺乏症(AATD)相关肝病。AATD是一种罕见的常染色体显性遗传病,该病严重损害患者的肝脏和肺部,据估计,在欧洲大约2500人中有1人受该病影响,在美国约3000~5000人中有1人受该病影响。
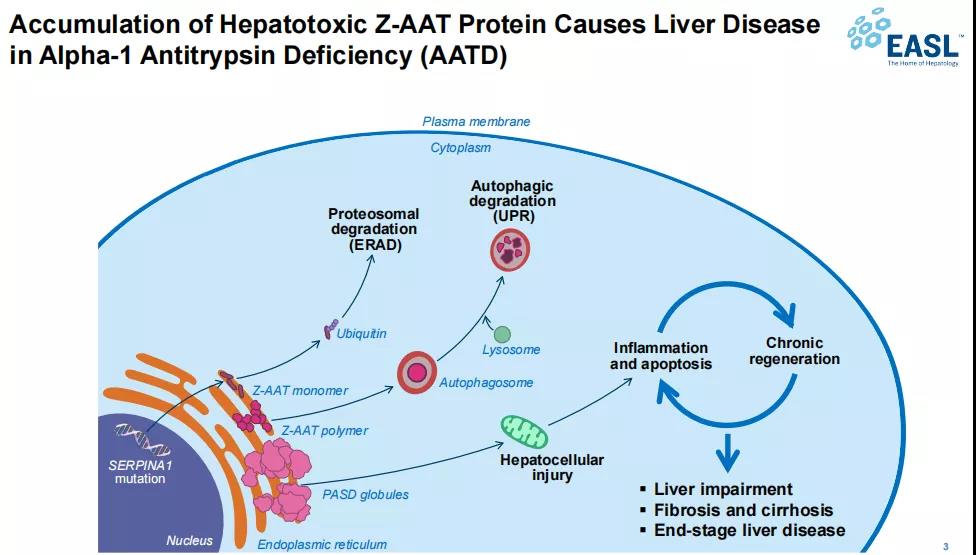
▲AATD致病机制
图源:Arrowhead Pharmaceuticals
α1-抗胰蛋白酶(AAT)是一种由肝细胞合成的重要蛋白质,其功能是抑制那些能够分解正常结缔组织的蛋白酶,以维持组织细胞完整性。AATD正是由于编码AAT的SERPINA1基因发生突变,使体内正常AAT浓度下降而导致。最常见的疾病变体是Z突变,该变体会导致单个氨基酸被替代,引起蛋白质的错折叠,无法有效分泌并在肝细胞内堆积,继而引发持续的肝细胞损伤。纯合PiZZ基因型的个体严重缺乏功能性AAT,导致肺部和肝脏疾病。肺部疾病常用AAT增强疗法,但针对肝脏疾病并无特定疗法,只能依靠肝脏移植,因此该领域存在大量未满足的需求。
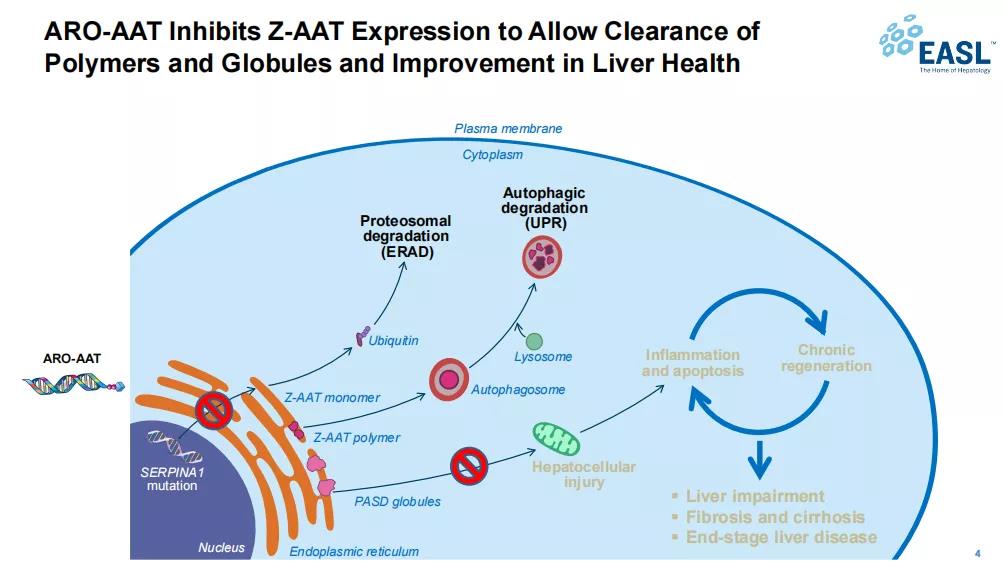
▲ARO-AAT作用机制
图源:ArrowheadPharmaceuticals
ARO-AAT旨在通过“沉默”患者突变的SERPINA1基因以减少突变Z-AAT蛋白的产生,防止Z-AAT蛋白在肝脏中累积,并清除突变Z-AAT蛋白,阻止造成细胞损伤的恶性循环,并可能减缓甚至逆转肝纤维化的进展。2020年10月,Arrowhead与武田制药达成协议,双方将共同开发和商业化ARO-AAT,根据协议,Arrowhead将获得3亿美元的预付款(已于2021年1月完成),并有资格获得高达7.4亿美元的潜在开发、监管以及商业化里程碑付款;武田将获得在美国以外地区的ARO-AAT独家商业化许可,Arrowhead将有资格获得净销售额20~25%的特许权使用费。2021年7月,公司宣布ARO-AAT(也称TAK-999)获得FDA授予的突破性疗法认定,用于治疗α-1抗胰蛋白酶缺乏症(AATD)相关肝病。此外,该药物此前还获得了FDA的孤儿药认定和快速通道认定,以及欧盟委员会的孤儿药认定。
2021年11月,Arrowhead在2021年美国肝病研究学会年会(AASLD2021)上披露了ARO-AAT2期研究的最新数据(数据截取至2021年8月31日)。数据显示,经过ARO-AAT的治疗,患者血清内以及肝脏内Z-AAT蛋白水平显著且持续降低。

病理学分析显示,17例患者中有6例患者的肝纤维化获得1级以上的改善,6例患者无明显变化,2例患者较基线出现1级以上的恶化;患者肝脏组织内的球状聚集体减少;肝脏健康的临床相关生物标志物持续减少;同时显示出良好的耐受性与安全性。
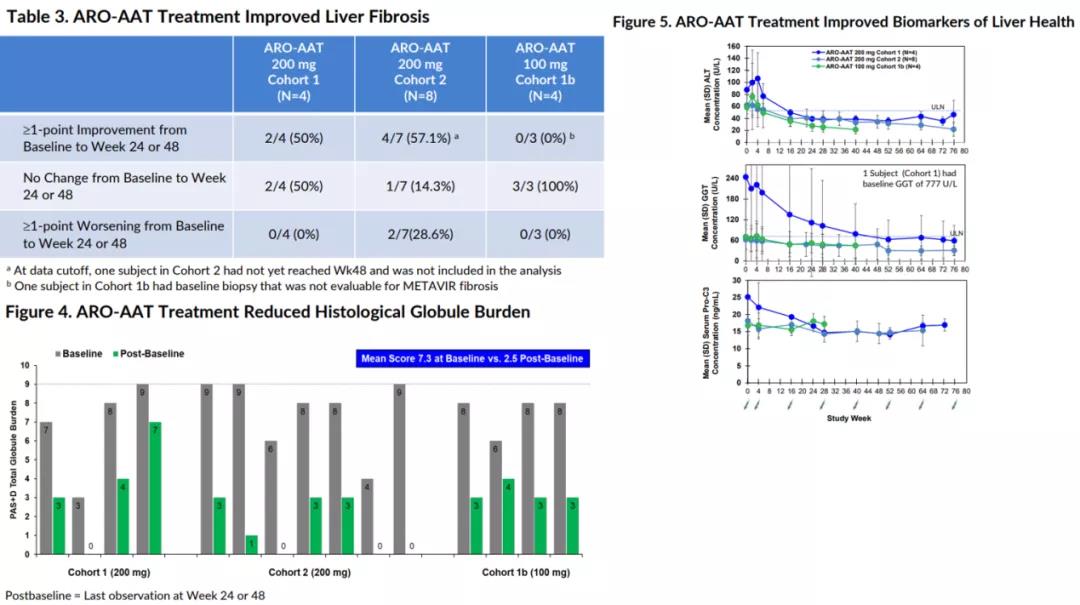
药融云数据www.pharnexcloud.com显示ARO-AAT正在开展一项开放标签、多剂量的2期临床试验,旨在评估ARO-AAT在α-1抗胰蛋白酶缺乏症(AATD)相关肝病患者中的安全性与有效性,预计主要终点完成时间为2023年8月(NCT03946449);同时,公司还在开展一项名为SEQUOIA的安慰剂对照、多剂量2/3期临床试验,以评估ARO-AAT在AATD患者中的安全性、耐受性与药效学效应,预计主要终点完成时间为2022年7月(NCT03945292)。

▲来源:药融云数据库
ARO-C3是公司新开发的一款抑制肝脏合成补体C3的RNAi疗法,旨在治疗补体介导的肾病和血液疾病,这是公司基于TRIM™平台开发的第10个临床项目,也是第8个针对肝脏表达蛋白的临床项目。2021年10月,Arrowhead宣布公司已提交一项1/2a期临床试验申请,计划评估ARO-C3在24名成年健康志愿者、24名伴有阵发性夜间血红蛋白尿(PNH)成年患者、14名补体介导肾病成人患者中的安全性、耐受性、药代动力学和药效学,计划于2022年第一季度开始首例患者给药。
ARO-XDH是一款靶向黄嘌呤脱氢酶(XDH)的RNAi疗法,被开发用于治疗现有疗法“无法控制”的痛风。黄嘌呤脱氢酶(XDH)是将嘌呤降解产生尿酸代谢途径中的重要催化酶,ARO-XDH通过降低XDH水平,以抑制尿酸的产生,从而控制痛风的进展。2021年6月,Arrowhead与爱尔兰制药公司Horizon Therapeutics宣布达成全球合作与许可协议,共同开发ARO-XDH。根据协议,Arrowhead将获得4千万美元的首付款(已在2021年7月完成),并有资格获得高达6.6亿美元的潜在研发、监管和商业化里程碑付款以及销售分成;Arrowhead负责临床前开发工作,Horizon负责临床研究与商业化。目前,该候选疗法处于临床前研究阶段。
针对肝脏,除上述候选疗法之外,公司根据与杨森公司达成的协议,正在为杨森开展ARO-JNJ1、ARO-JNJ2和ARO-JNJ3的药物发现、优化、临床前研究与开发工作,具体靶点与适应症未披露。
肿瘤
ARO-HIF2是公司开发的一款潜在的肾透明细胞癌(ccRCC)药物,也是Arrowhead首个肝外靶向的全身性RNAi疗法,旨在抑制HIF-2α的表达,该治疗靶点与ccRCC肿瘤细胞的进展和转移密切相关。2020年8月,公司开启了一项1b期剂量探索研究,旨在评估ARO-HIF2注射液的安全性与有效性,并确定ARO-HIF2治疗晚期ccRCC患者的2期推荐剂量(NCT04169711),预计主要终点完成时间为2022年3月。
2021年7月,Arrowhead披露了1b期剂量探索研究的中期结果,在17例患者分别接受ARO-HIF2225 mg IV QW (cohort 1, n=7) 或525 mg IV QW (cohort 2,n=10),结果显示出清晰的靶点结合信号和至少一例患者显示出早期有效性信号,目前研究已经推进到1050mg IV QW (cohort3),患者正在招募中。其中,9例患者接受了组织活检,可进行评估。免疫组织化学检测显示,9例患者中有7例HIF2α蛋白表达量下降,平均减少48%(9%~82%)。RECIST评估显示,cohort2中有1例患者部分缓解(PR),肿瘤缩小65%,另有5例患者病情稳定(SD),治疗持续12~24周时,仍有4例患者在组。同时,ARO-HIF2治疗耐受性良好,没有报道药物相关性贫血。
肺部
ARO-ENaC是公司开发的一款治疗囊性纤维化(CF)的RNAi疗法,旨在抑制肺气道中上皮细胞钠离子通道α亚基(αENaC)的活性。在囊性纤维化患者中,ENaC活性增加将导致气道脱水并抑制粘液纤毛传输系统。囊性纤维化是一种罕见的遗传病,患者可能呼吸困难,并经常出现持续性肺部感染。2020年8月,公司开启了一项1/2a期剂量递增试验,旨在评估ARO-ENaC吸入剂在健康成人志愿者以及囊性纤维化患者中的安全性、耐受性、药代动力学和药效学(NCT04375514)。然而在2021年7月,公司在收到慢性毒理学研究的初步数据后立即宣布暂停该1/2a期研究,原因是在对大鼠进行的慢性毒理学研究发现肺部局部炎症信号,目前公司正在等待非临床慢性毒理学研究的剩余数据。
ARO-Lung2是公司新开发的慢性阻塞性肺病(COPD)潜在疗法,治疗靶点未披露。目前处于临床前研究阶段。此外,ARO-COV正在被开发以对抗目前流行的新型冠状病毒,以及未来潜在肺部感染性疾病的病原体,目前处于临床前研究阶段。
肌肉
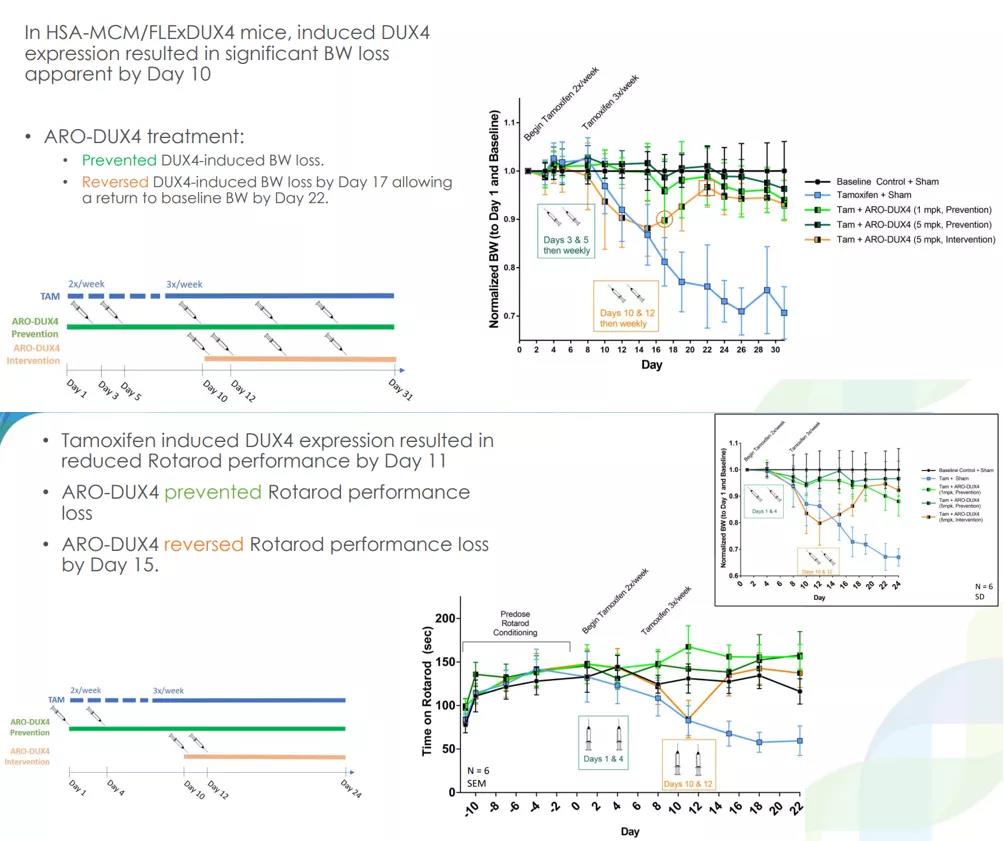
ARO-DUX4是一款面肩肱型肌营养不良症(FSHD)潜在疗法,该病是一种常染色体显性遗传病,与分化骨骼肌中DUX4表达未能保持完全的表观遗传抑制有关,导致DUX4过表达,具有肌毒性,可导致肌肉退化。ARO-DUX4旨在选择性靶向和敲低DUX4,从而实现肌肉修复和肌肉功能的改善。
2021年6月,Arrowhead在第28届FSHD学会国际研究大会上披露了ARO-DUX4的临床前研究数据。在小鼠体内静脉注射3mg/kg剂量的ARO-DUX4,实现药物递送至76-99%的腓肠肌肌纤维中;非人类灵长类动物接受10mg/kg剂量3次给药(day1, 7,28),实现血清肌肉生长抑制素(myostatin)水平减少79%,到第12周仍观察到70%以上的减少。ARO-DUX4还实现了DUX4的剂量依赖性敲低,在FSHD样转基因小鼠模型中,ARO-DUX4预防并逆转了DUX4靶基因的过表达;防止DUX4引起的体重丧失;在第17天逆转了DUX4引起的体重下降,在第22天恢复到基线体重;预防并逆转了肌肉纤维化,改善了小鼠在旋转棒疲劳试验中的表现。
财务状况
2020年11月23日,Arrowhead公布2020财年财务状况(2019年10月1日至2020年9月30日),公司2020财年总收入8799.2万美元,研发支出为1.288亿美元,一般及行政开支为5227.5万美元。总的来说,公司2020财年净亏损8455.3万美元,截至2020年9月30日,公司的现金和现金等价物共1.4358亿美元,总资产5.225亿美元。

▲图源:Arrowhead Pharmaceuticals财报
2021年8月5日,Arrowhead公布2021财年前三季度财务状况(2020年10月1日至2021年6月30日),公司2021财年前三季度总收入1美元,研发支出为1.4亿美元,一般及行政开支为4358.1万美元。总的来说,公司2021财年前三季度净亏损8415.3万美元,截至2021年6月30日,公司的现金和现金等价物共3.2598亿美元,总资产7.3493亿美元。
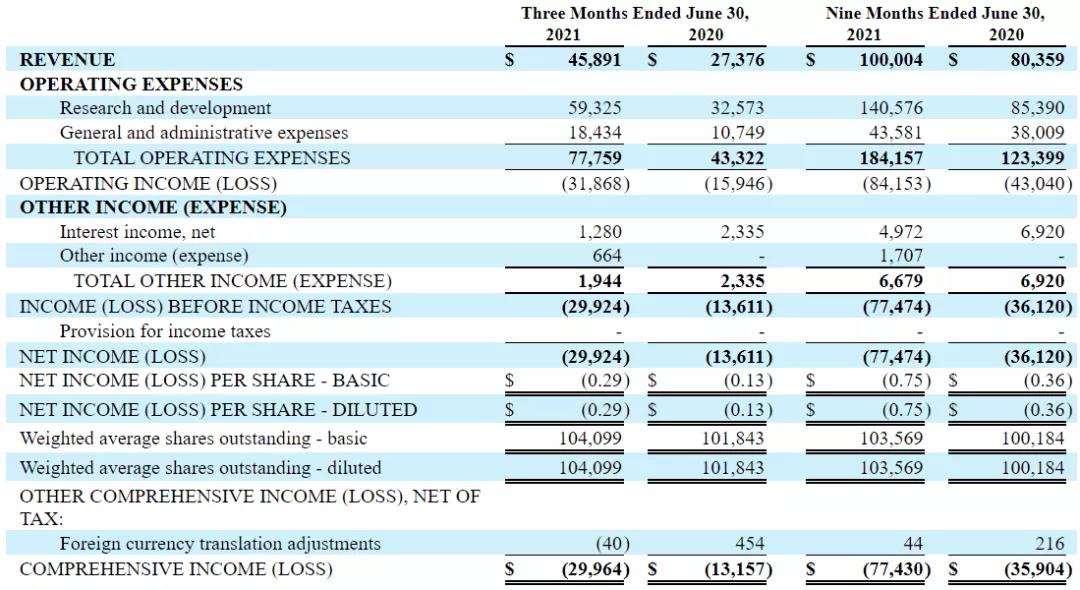
▲图源:ArrowheadPharmaceuticals财报(Inthousands)
2021财年业绩将于美东时间2021年11月22日下午公布。
参考资料:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA/PMDA;
相关公司公开披露;
Matzke MA, Matzke AJ. Planting the seeds of a newparadigm. PLoS Biol. 2004;2(5):E133.doi:10.1371/journal.pbio.0020133;
Noura S. Abul-Husn et al. A Protein-TruncatingHSD17B13 Variant and Protection from Chronic Liver Disease. N Engl JMed. March 22,2018.;
https://ir.arrowheadpharma.com/news-releases/news-release-details/arrowhead-pharmaceuticals-receives-breakthrough-therapy;
2020年报,https://ir.arrowheadpharma.com/node/15851/html
2021三季报,https://ir.Arrowheadpharma.com/node/16361/html;等等。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论