重组蛋白疫苗作为新冠疫苗技术路线之一,由于该路线的疫苗产品对生产车间的生物安全等级要求低,且具备纯度高、安全性更好、能实现高产量、高纯度、低成本等优势,一直备受关注。国内除智飞生物的三针免疫程序的重组亚单位疫苗获批紧急使用外,丽珠医药子公司珠海市丽珠单抗生物技术有限公司也自2020年7月联合中国科学院生物物理研究所彭华研究团队,合作研发了创新型新冠重组蛋白疫苗V-01,该项目具独立自主知识产权,不会出现原料“卡脖子”的问题。根据公司最新进展,业内人士推测,V-01是目前已知的第一个序贯加强取得三个国家层面审批的疫苗项目:中国、巴基斯坦、马来西亚。
V-01加强针中和抗体滴度增加高达60倍
值得注意的是,V-01自身加强针临床试验于2021年8月6日获我国CDE批准,并获科技部人遗办批准(批准号:国科遗办审字[2021]GH3373号)。近期初步研究结果已在预印版网站MedRxiv在线发表。该研究是在I期10μg试验组(43例受试者)接种两剂V-01后4~5个月进行第三针V-01加强免疫。
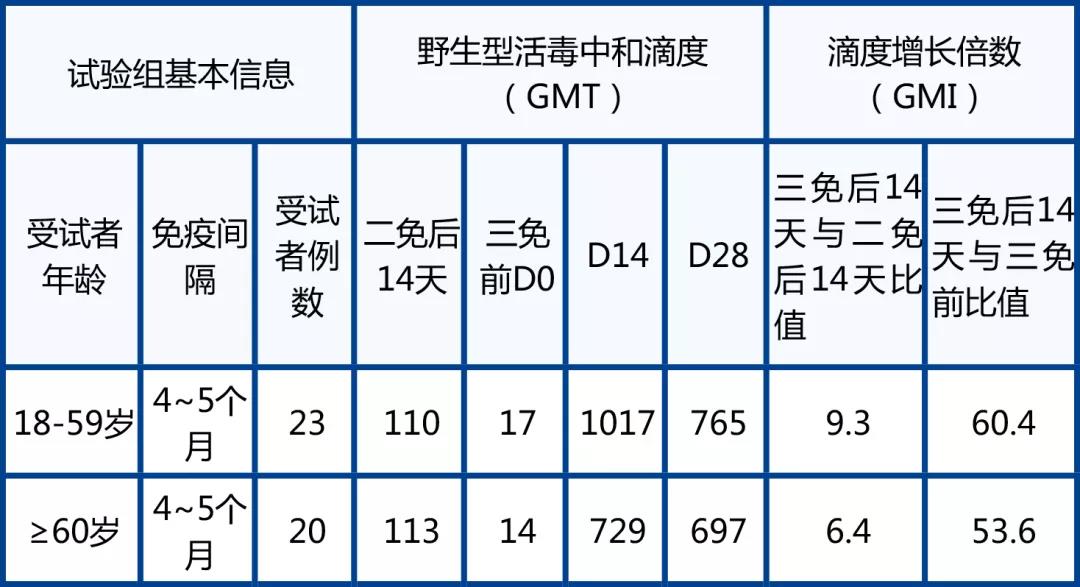
1. 活病毒中和抗体水平呈现快速、大幅度增加。与加免前比较,至14天,野生型中和抗体增加高达60.4倍(GMT滴度为1017),且三免后 14 天是二免后14天最高9.3倍。交叉中和研究(假病毒)结果表明,加强免疫后,对各种流行变异株VOC(包括Delta, Beta,Alpha)都维持在高滴度水平,其中Delta和Alpha与野生型中和抗体滴度相当。
2. 老年组加强效果好。老年组和成年组加强免疫后的中和抗体滴度和增长倍数均相当。
3. 安全性良好。V-01自身加强针具有较好的安全性和耐受性,总体上没有不良反应(AE)。
全球竞赛,V-01已在5国进入III期临床

2021年11月8日,俄罗斯卫生部国家研究许可登记册网站发布消息,俄卫生部已颁发许可证,批准V-01开展作为基础免疫的III期临床研究,在此之前,菲律宾、印度尼西亚的基础免疫方案III期临床试验已正在进行之中。
此外,V-01已在巴基斯坦、马来西亚开展作为加强针的灭活序贯免疫的III期临床试验。
药融云数据显示:V-01为重组蛋白疫苗,可在2-8℃冷链运输及长期储存;截止 2021年10月27日,在V-01项目已累计研发投入约为人民币25,291.58 万元。
以下为在线论文摘要翻译文,仅供参考。

重组新型冠状病毒融合蛋白疫苗(V-01)同源加强针在初免两针疫苗的健康成年受试者中的免疫原性和安全性
摘要
背景:随着人们对疫苗的免疫性减退及其对变异毒株(VOC)的中和活性降低的担忧日益加深,这使得需要通过不同的策略部署采用加强针来应对新冠疫情。I期和II期临床试验的初步研究结果表明,重组新型冠状病毒融合蛋白疫苗V-01在1060名成年受试者(含青年及老年)中表现出良好的安全性和免疫原性。本文旨在评估加强针在I期临床试验中已接受两剂10µg V-01初免(第0天和第21天)的受试者中的免疫原性和安全性,为接种同源加强针的必要性和可行性提供可靠数据。
方法:我们在广东省疾病预防控制中心(中国高州)开展了一项单臂、开放性试验,从I期临床试验中选取43名在4-5个月前接受两剂10µg V-01初免的合格受试者接种加强针。首先,通过ELISA法检测RBD结合抗体,并使用中和试验检测V-01对野生型SARS-CoV-2和新的VOC的中和活性,进而评估加强针接种后的免疫原性。其次,我们还评估了接种疫苗加强针的安全性和反应原性。
结果:在已接受两剂10µg V-01初免的受试者中,第三剂V-01对野生型SARS-CoV-2和VOC均表现出明显的体液免疫应答增强作用。结果显示,与加强针接种前相比,青年受试者中V-01对SARS-CoV-2的中和滴度增加了60.4倍,抗体几何平均滴度(GMT)由加强针接种前的17(95%CI:12-23)增加到加强针接种后第14天的1017(95%CI:732-1413);而老年受试者的中和滴度增加了53.6 倍,GMT由加强针接种前的14(95%CI:9-20)增加到加强针接种后第14天的729(95%CI:397-1339)。
从加强针接种前一天到加强针接种后第14天,V-01对SARS-CoV-2德尔塔毒株的中和滴度也明显增加,其中青年受试者的GMT从11(95%CI:8-15)增至383(95%CI:277-531)(增加35.4倍),老年受试者的GMT从6.5(95%CI:5-8)增至300(95%CI:142-631)(增加46.0倍)。结果还显示,从第二次接种后第28天到加强针接种后第14天,V-01对新的VOC的假病毒中和滴度显著且持续增加,其中,针对阿尔法毒株的GMT从206(95%CI:163-259)增至607(95%CI:478-771),针对贝塔毒株的GMT从54(95%CI:38-77)增至329(95%CI:255-425),针对德尔塔毒株的GMT从219(95%CI:157-306)增至647(95%CI:484-865)。我们的初步研究结果表明,V-01同源加强针具有较好的安全性和耐受性,总体上没有不良反应(AE),或AE严重程度为轻度至中度,且未见与加强针接种相关的3级或以上的AE。
结论:接受同源加强针免疫后,已接种两剂V-01初免的受试者可产生显著的针对野生型SARS-CoV-2和新的VOC的体液免疫应答,且该加强针具有良好的安全性和反应原性。本研究为使用重组蛋白疫苗开展同源初免-加强免疫以应对持续疫情的策略提供了有价值数据,并可能对新的VOC具有广泛的保护作用,同时解决免疫性减退的问题。
总 结

新冠疫情百年一遇,长期抗疫斗争已不可避免,据媒体报道,国务院联防联控机制科研攻关组疫苗研发专班工作组组长郑忠伟提到:“通过同技术路线和不同技术路线疫苗的加强接种,我们相信对新冠病毒不管是目前存在的各类变异病毒,在预防感染、预防重症和死亡方面都有更好的效果。因此下一步我们将推出最优的加强免疫组合,来为我们的加强免疫提供帮助,我想大家应该会很快看到这样的一个结果。”
中科院生物物理研究所联合丽珠医药合作开发的V-01凭借着创新性的融合蛋白设计,在临床前及临床阶段表现良好的疗效与安全性,同时基于其较大规模的临床试验设计,若其临床III期结果未来呈积极态势,不排除将给众多人群提供有效保护。
参考:
NMPA/CDE;
药融云数据,www.pharnexcloud.com;
FDA/EMA;
相关公司公开披露;
丽珠医药公告;
Immunogenicity and safety of the homogenous booster shot of a recombinant fusion protein vaccine (V-01) against COVID-19 in healthy adult participants primed with a two-dose regimen ;https://www.medrxiv.org/content/10.1101/2021.11.04.21265780v1;
中国临床试验注册中心http://www.chictr.org.cn;
等等。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论