一、概述
FDA现场检查主要目的:①检查申报文件(ANDA与DMF)有原始数据支持与现行现场文件记录中的数据是否一致,是否完整、准确、可靠;②是否违反cGMP现象,确保产品生产满足cGMP要求;③检查设施、设备是否适合生产合格产品,确保质量系统能够正确正常运行;④检查企业质量控制系统对数据完整性的实施以及如何对原始数据进行存储;⑤检查企业是否遵循文件中的承诺。
核查药品注册申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等,对研制现场和生产现场开展的核查活动。
现就仿制药(ANDA)注册现场审计经验分享给药学同行们,此次总结和归纳内容,主要分享如何迎接FDA现场检查(审计)与批准前现场检查整个过程2大部分展开。
二、迎接现场审计的流程框架
- 1、接到现场检查通知
- 2、根据时限制定公司自查计划
- 3、根据核查范围与主要内容,企业自查与准备
三、主要内容
(1)迎接现场检查通知
- 1、FDA官方对提交的电子资料审核通过后,根据制剂生产厂家申请会发函通知给API制药公司。
- 2、根据发函内容翻译成中文,组织相关部门进行会议,发放各个职能部门。
- 3、成立自查小组,以及迎检小组,小组成员涉及:研发、生产、注册、质量、QA、QC、仓储、财务等相关部门人员。
(2)制定公司自查计划并完成现场检查前企业内部自查
- 1、公司自上而下1个星期进行全面检查。
- 2、范围与时间:仓库1天、研发1天、生产2天、质量2天(QC、QA),根据情况各部门内部自己进行一次自查。
- 3、整理汇总自查报告,分发各个部门,各部门进行整改。
(3)检查范围与主要内容
1、检查范围:生产系统、物料与仓储系统、质量系统、厂房设施设备系统、实验室控制系统、文件系统、包装标签系统、发运系统。
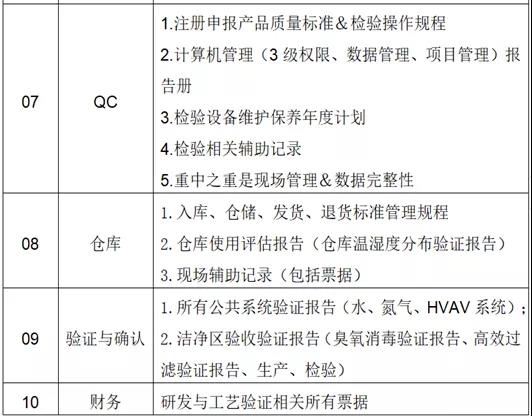
2、检查主要内容

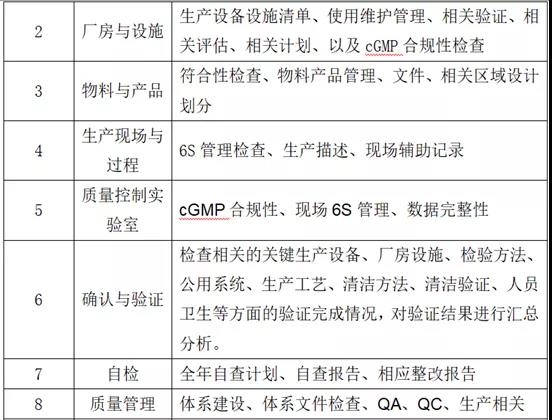
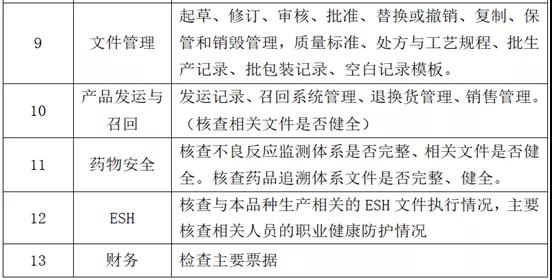
(4)现场检查准备
- 1、宗旨:重视现场检查、尊重检查官、本着学习不断持续改进。
- 2、战略为主,战术为辅(战略:一切以通过为最终目标;战术:以检查官为中心)。
- 3、准备英文稿,公司简介PPT(公司具体位置、公司主特色、公司发展历程、营业执照、药品生产许可证、出口欧盟原料药证明文件、组织架构图、公司法定代表人履历、公司布局全图、全景(QA、办公室、财务)、质量控制室简介(主要检测设备&部分主要房间)、质量管理部职责、QA保证主要职责、QC控制主要职责、质量控制架构、质量控制布局全图、仓储布局全图与简介、水系统&氮气系统&HVAC系统简介、生产区域布局及车间简介、产品研发状态、产品列表、检查产品的生产工艺等。
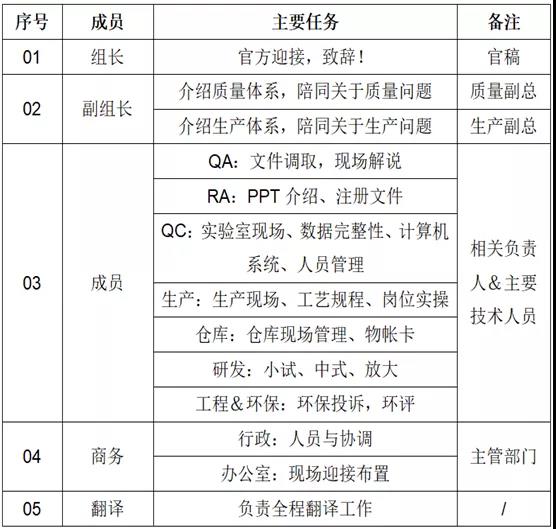
- 4、成立迎检小组:

- 5、任务划分:
四、总结:
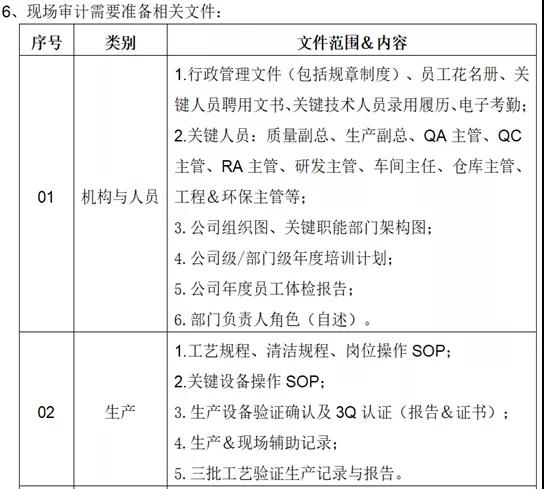
公司自查完成后,根据相应整改措施进行整改,并保持良好的公司全面运行状态,迎接现场检查;准备工作已做充足,接下来就是迎检现场检查以及准备,下篇内容详细讲解全程检查活动,以及现场的应对答复。


<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论