国内CAR-T公司走过了主题投资和技术验证2个阶段,已经进入产品兑现阶段。近日,复星凯特的CAR-T产品阿基伦塞注射液在国内获批上市,是国内首个上市的CAR-T细胞疗法。药明巨诺的CAR-T产品去年已申报上市,等待获批;北恒生物通用型CAR-T产品CTD401获得美国FDA孤儿药资格认定,国产CAR-T产品的实力得到进一步验证。
一、CAR-T细胞疗法市场空间
CAR-T细胞是经基因改造的T细胞,配备有嵌合抗原受体(CAR),它能使T细胞识别并消灭表达相应抗原的细胞。自体CAR-T细胞是通过从患者血液中取出T细胞,并通过带有对CAR结构编码的质粒的病毒载体转染等方式,使T细胞表达所需的CAR而产生的。
二、CAR-T细胞治疗过程的示意图
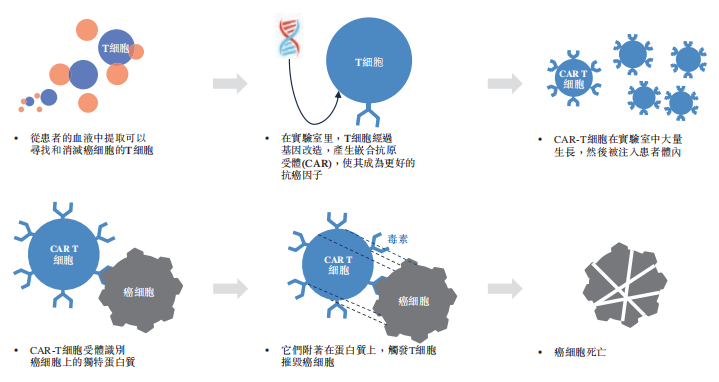
资料来源:Frost & Sullivan 科济药业招股书
自2017年首批两个CAR-T产品获批以来,全球CAR-T市场一直在迅速扩大。全球CAR-T市场规模已从2017年的0.1亿美元增长到2019年的7亿美元,预计全球CAR-T细胞疗法市场的销售价值达至2024年的66亿美元,2019年至2024年的复合年增长率为55.0%。截至2030年,按销售价值计,全球CAR-T市场规模预计达至218亿美元,2024年至2030年的复合年增长率为22.1%。
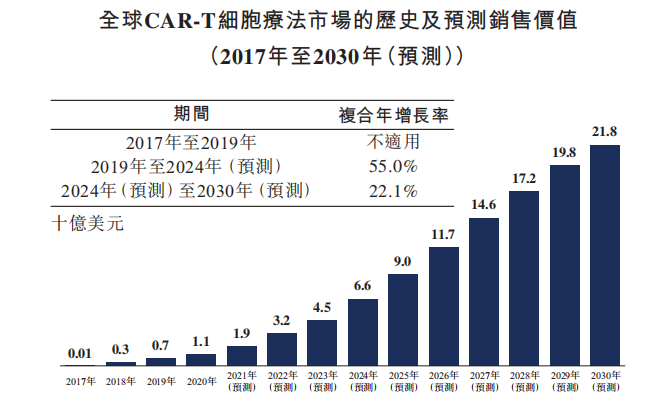
资料来源:Frost & Sullivan 科济药业招股书
Frost&Sullivan估计今年中国CAR-T疗法的市场规模为人民币2亿元。预计中国CAR-T细胞疗法市场规模将增长至2024年的人民币53亿元,并进一步增长至2030年的人民币289亿元,2022年至2030年的复合年增长率为45.0%。
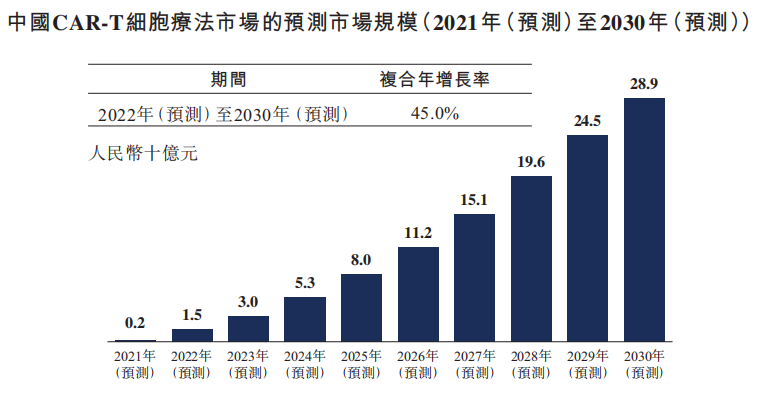
资料来源:Frost & Sullivan 科济药业招股书
三、CAR-T细胞疗法全球研发格局
全球获批上市的CAR-T细胞疗法有诺华的Kymriah、吉利德的Yescarta及Tecartus、BMS的Liso-cel、蓝鸟生物Abecma,其中四款靶向CD19和一款靶向BCMA的 CAR-T 细胞疗法。近日复星凯特的阿基伦塞注射液获批在国内上市。目前还有正在申请上市的,包括瑞基仑赛注射液和西达基奥仑赛。
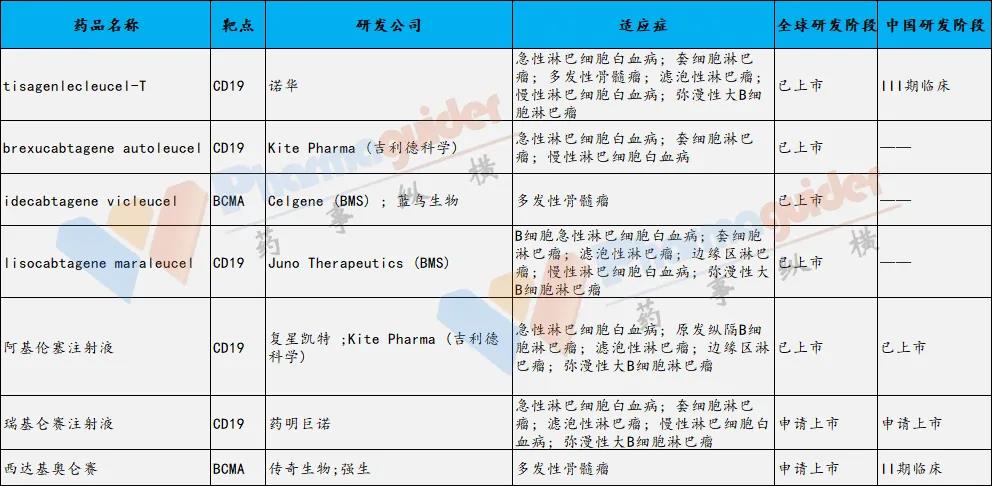
数据来源:公开信息 药事纵横整理
截止到发稿日,目前全球 CAR-T 细胞疗法研发管线从临床前到三期有580个左右,临床1期研发管线有290个。处于Ⅱ期阶段及以上的有27个,其中大部分针对CD19靶点。目前据统计注册于 Clinicaltrials 上的国内 CAR-T 临床试验已超 365 项。
赛道拥挤,有点类似PD-1扎堆的状态,未来竞争会非常激烈。产品已经获批或研发靠前的公司相对来说具有先发优势,大部分后来者未来需要看商业化能力。
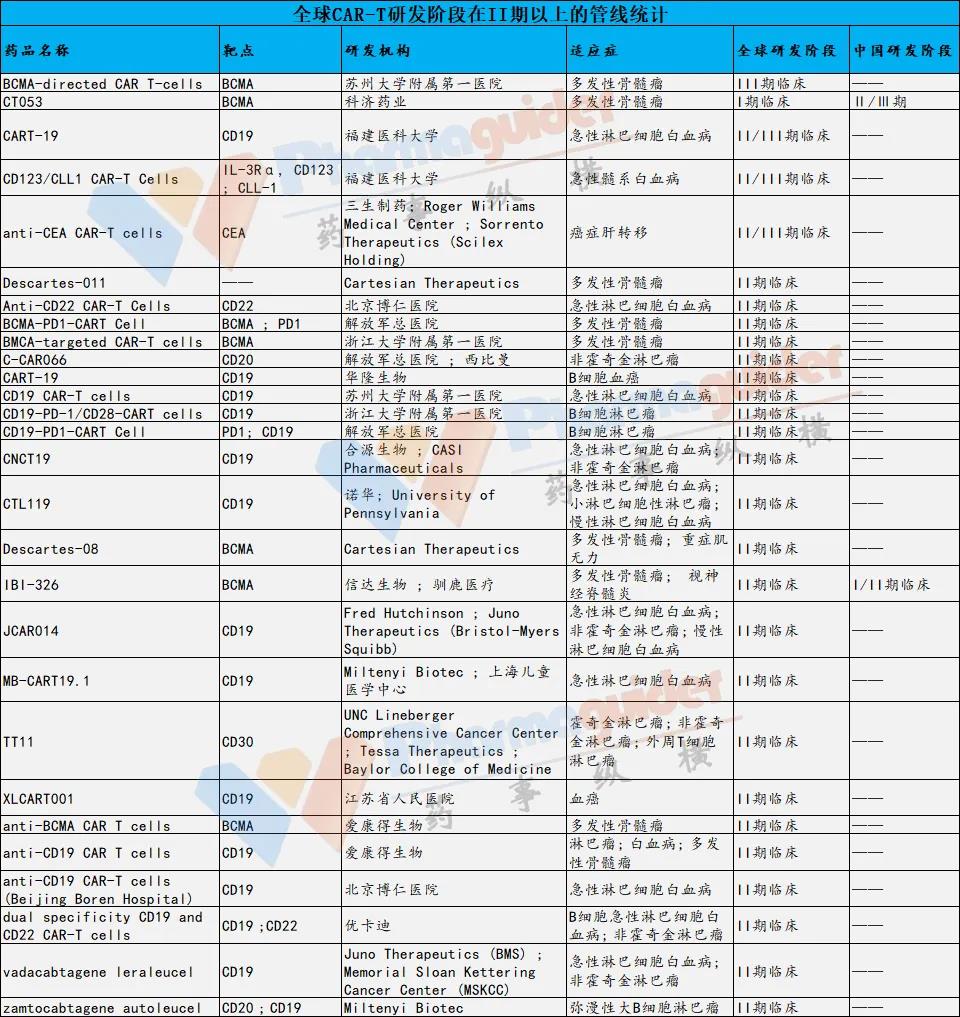
数据来源:药融云数据 药事纵横整理
CD19是在B谱系的淋巴细胞上表达的整合膜糖蛋白。它是参与B细胞活化和增殖的重要膜抗原之一,其在除浆细胞外的所有B细胞系上表达。CD19参与调节B细胞受体依赖性(BCR依赖性)和独立信号传导,因此对于机体发挥最佳免疫反应至关重要。
对于大多数B细胞恶性肿瘤(例如NHL),所有患者的癌细胞中CD19均为正常至高水平。获FDA批准的五种CAR-T细胞疗法的四种(即Breyanzi、Tecartus、Yescarta及Kymriah)靶向CD-19。在中国,刚获批的复星凯特的CAR-T产品和已经递交上市申请的药明巨诺的CAR-T产品都是靶向CD19。
四、国内CAR-T细胞疗法主要公司
目前国内布局CAR-T细胞疗法的公司或者机构非常多,我们精选几家产品即将兑现的公司简单点评下,需要了解更多的公司和最新行业信息,可以参加”免疫江湖”细胞和基因疗法论坛。

聆听传奇生物、和元生物、宜明细胞、复星医药、辉大基因、清华长三角研究院细胞药物转化公共服务平台等基因&细胞领域重量级专家分享最新的信息。

2020年6月30日,药明巨诺提交的瑞基仑赛注射液上市申请获得CDE受理,是国内继复星凯特益基利仑赛之后第2款申报上市的CAR-T疗法。药明巨诺(港交所代码:2126)是一家领先的细胞免疫治疗公司,由巨诺医疗(一家百时美施贵宝的公司)和药明康德联合创建。公司已建立了一个专注为血液及实体瘤开发、制造和商业化的突破性细胞免疫疗法的一体化平台。药明巨诺的 JWCAR029 已获的“优先审评+突破性药物”双重审评资格。
研发管线如下
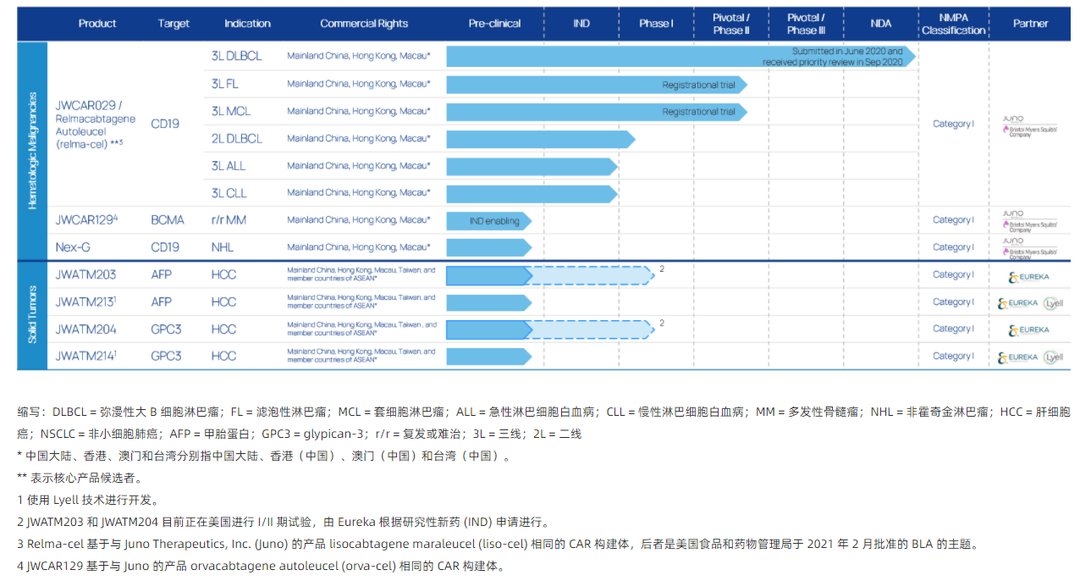
资料来源:药明巨诺官网

传奇生物(LEGN.US)在今年5月底宣布,FDA已接受优先审查西达基奥仑赛(cilta-cel)的生物制品许可申请(BLA)。cilta-cel是一种在研的靶向BCMA的CAR-T疗法。根据处方药使用者付费法案(PDUFA),FDA将在2021年11月29日前完成对该BLA的审查。据悉,优先审查通常适用于能明显改善重大疾病的治疗、预防或诊断的在研疗法。此前,cilta-cel已于2019年12月获得突破性治疗药物认定,该认定旨在加快潜在新药的开发和审查。cilta-cel主要用于接受过多重治疗的多发性骨髓瘤患者,目前在中国处于2期临床阶段。
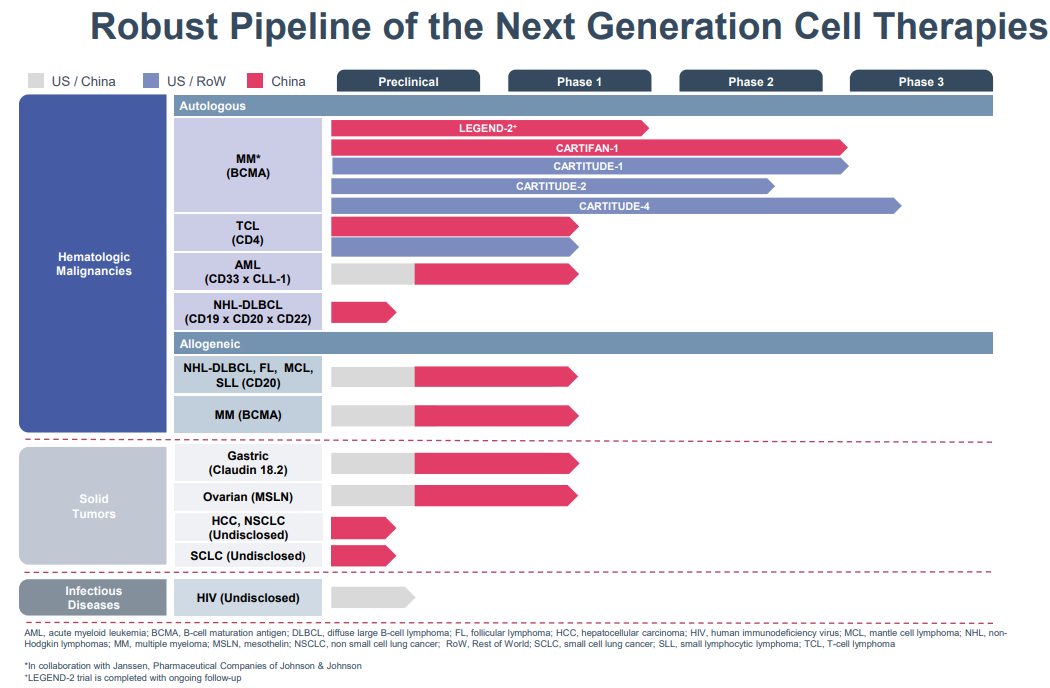
资料来源:传奇生物
科济药业(2171.HK)是一家专注于研发治疗血液恶性肿瘤和实体瘤的创新 CAR-T 细胞疗法公司,近日在港股上市。公司目前拥有四款处于临床阶段的 CAR-T 产品,其中 CT053 为一款靶向 BCMA 的 CAR-T 产品,目前处于Ⅱ/Ⅲ期。2020年12月8日,公司的CT053全人抗BCMA自体CAR T细胞注射液通过国家药品监督管理局(NMPA)药品审评中心(CDE)公示期,纳入突破性治疗药物品种,拟定适应症为复发难治性多发性骨髓瘤(R/R MM)。
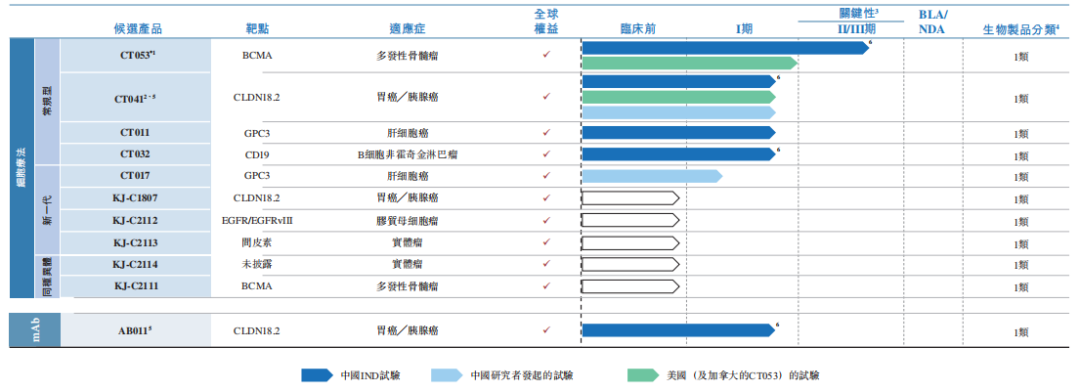
资料来源:科济药业招股书
五、总结
全球癌症发病率上升,适应症向实体瘤扩展,制造技术及效率提高,安全性改善和政策利好等因素是推动未来全球CAR-T市场的主要增长动力。目前国内的复星凯特CAR-T产品正式获批上市、药明巨诺的CAR-T产品也已申报上市,预计今年也将获批上市。传奇生物和科济药业研发靠前,还有不少公司管线处于1-2期研发阶段,CAR-T赛道也是非常拥挤,未来商业化能力对很多公司是一种考验,不过我们相信未来会有更多国内公司在CAR-T赛道绽放。文中数据如有遗漏,欢迎留言。






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论