注:本文不构成任何投资意见和建议,以官方/公司公告为准;本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及)。因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场。
01

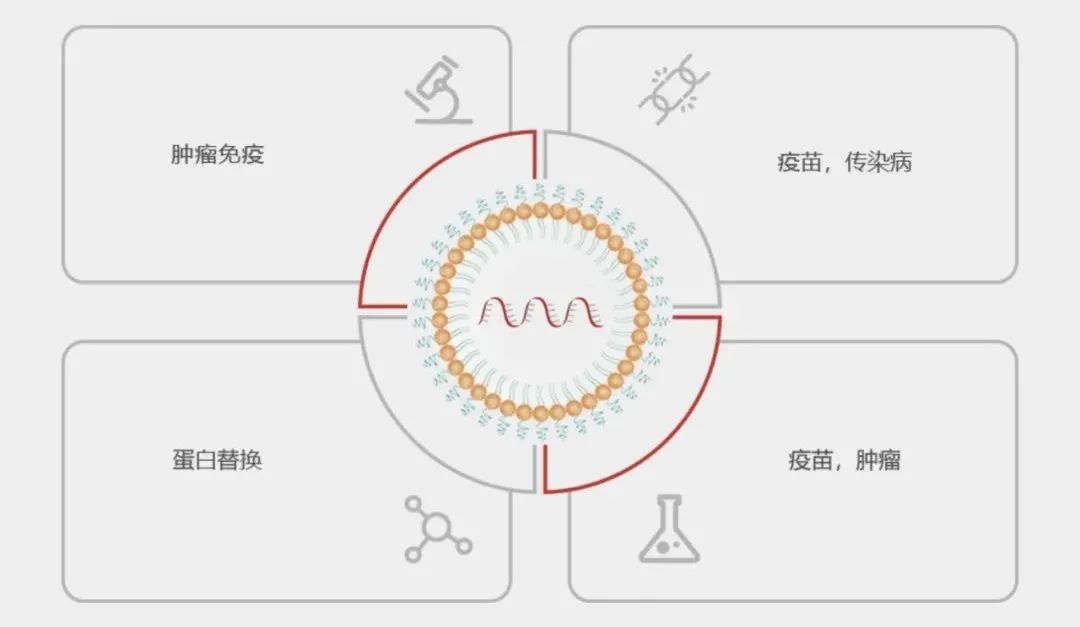
苏州艾博生物科技有限公司(Suzhou Abogen Biosciences)(母公司为ABOGEN LIFE SCIENCES)致力于基于核酸(siRNA, mRNA, DNA)的新药研发,目标领域包括传染病疫苗、肿瘤疫苗、肿瘤免疫和蛋白替换等。成立于2019年1月。
公司创始人在核酸药物研发领域有多年的经验,其设计的多个药品在美国已经入临床试验阶段。公司目前在苏州建立了科研基地,依托于为核酸药物量身打造的转化平台和世界一流的科研及管理团队,将在未来的3~5年内有多个项目进入临床及临床报批BLA阶段。
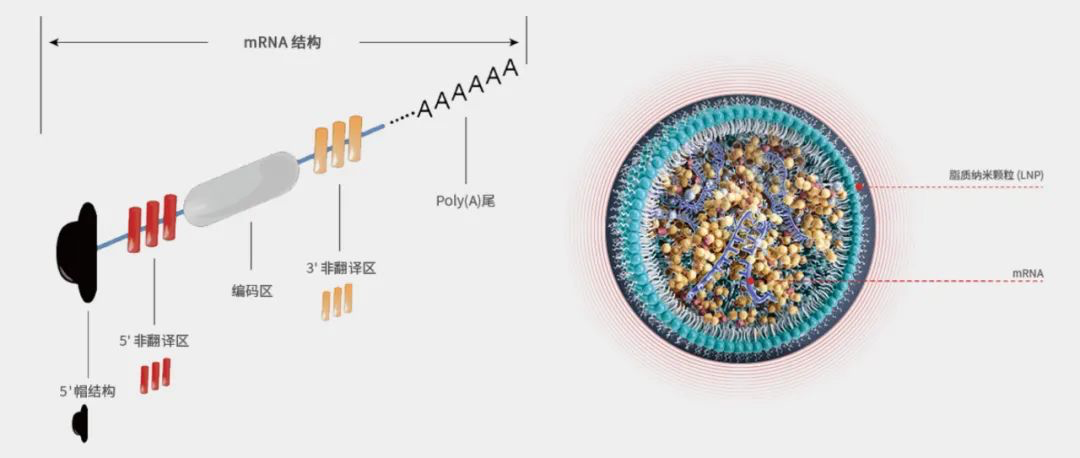
艾博生物与军事医学科学院(秦教授课题组)及云南沃森生物联合开展新冠mRNA疫苗(ARCoV)研发工作。据悉,艾博生物已建立了具有自主知识产权的mRNA和纳米递送技术平台,ARCoV疫苗即使用了自主开发的脂质纳米颗粒(LNP)。ARCoV疫苗的mRNA编码是的序列优化的新冠刺突S蛋白RBD区域,该mRNA长度仅为1100nt左右。假尿苷是否不可或缺,目前艾博的新冠疫苗采用未经修饰的mRNA。
2020年6月,ARCoV疫苗获得中国历史上第一个mRNA疫苗的临床试验批文,在浙江树兰医院启动I期临床试验。本款mRNA新冠疫苗在临床阶段显示了良好的安全性与免疫原性。此外,本疫苗采用2-8 °C的储存运输技术。此前在2020年9月发表相关文章在Cell杂志上。位于云南玉溪基地的新冠疫苗生产车间模块化厂房一期过程从2020年12月开始建设,2021年9月1日投入使用。

合作双方的利益
艾博生物按协议获得沃森生物支付的里程碑付款以及艾博生物为新型冠状病毒mRNA疫苗研发所支出的费用。按照协议约定,在新型冠状病毒mRNA疫苗获批上市后,沃森生物累计支付艾博生物的研发及临床里程碑费用共计为8000万元人民币。
沃森生物为新型冠状病毒 mRNA 疫苗在中国大陆及香港、澳门、台湾地区内行政批文的持有人,包括但不限于临床试验批文、上市许可批文。本项目研发获得的和新型冠状病毒mRNA疫苗相关的知识产权(除平台技术之外)归双方共同所有。基于本协议的履行产生的任何平台技术均归艾博生物单独所有。新型冠状病毒 mRNA 疫苗产品上市后,双方根据本协议约定分享收益。

2021年7月21日,中国临床试验注册中心(ChiCTR)数据显示,《评价新型冠状病毒(mRNA)疫苗在18周岁及以上人群中接种的保护效力、安全性和免疫原性的国际多中心、随机、双盲、安慰剂平行对照的III期临床试验》预注册登记,此外还有几项临床。沃森生物mRNA新冠疫苗第三剂加强针临床试验获国家局批准。
值得关注的是,艾博生物mRNA新冠疫苗海外3期临床已经在2021年5月份启动,计划入组28000例,剂量同样为15ug。(涉及墨西哥、印度尼西亚、尼泊尔等国家)

就在2022年1月24日,The Lancet Microbe (柳叶刀新创立的子刊)期刊在线发表了艾博生物、军事科学院军事医学研究院、沃森生物共同研制的新冠mRNA疫苗ARCoV的I期临床试验结果。本次单中心、双盲、随机、安慰剂对照、剂量递增的I期临床试验由李兰娟院士(多款新冠疫苗/药物)领导,在浙江杭州的树兰医院完成。

本次I期临床试验旨在评估编码新冠病毒刺突蛋白(S蛋白)受体结合域(RBD)的mRNA疫苗ARCoV的初步安全性、耐受性和免疫原性。该研究分为5μg、10μg、15μg、20μg、25μg共5个剂量组,共有120名受试者入组。研究数据显示首剂接种至全程免疫后28天内未发生严重不良事件。全身不良反应以发热最为常见,大多数受试者的发热症状在接种疫苗后的2天内消失。
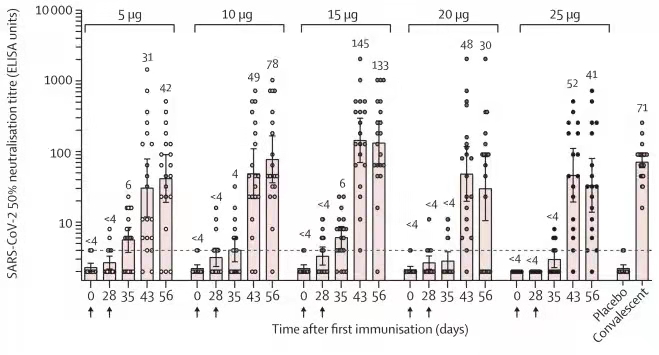
试验结果显示,ARCoV的15ug剂量试验组诱导的中和抗体滴度最高,大约是新冠康复患者血清的2倍。更多信息,需等待正在进行的3期临床试验验证的结果;只有艾博自己能解决目前的医药界/投资圈的一些争议与分歧。

02
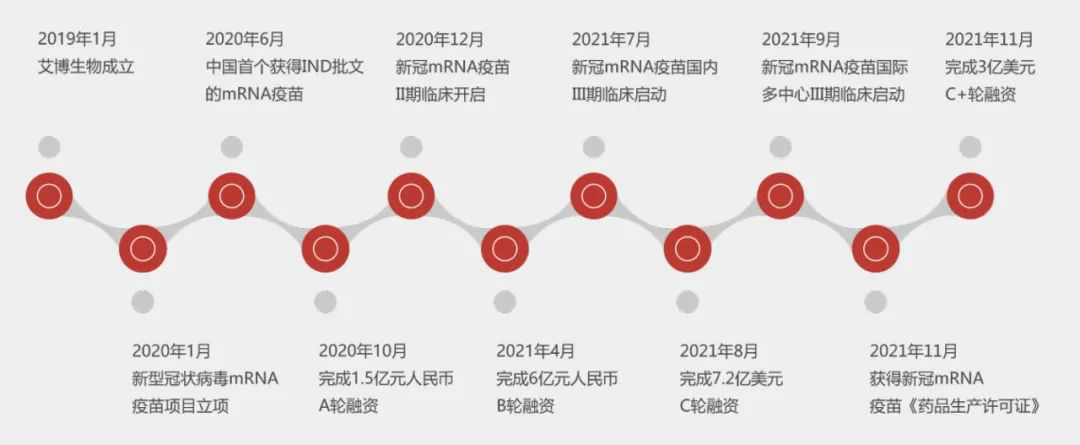
2020年10月,艾博生物宣布完成1.5亿元人民币的A轮融资。本轮融资由国投创业领投,高瓴创投、成都康华生物等共同投资。
2021年4月,艾博生物宣布正式完成6亿元B轮融资。本轮融资由人保资本、国投创业、云锋基金共同领投,高瓴创投、泰福资本、聚明创投、济峰资本、弘晖资本等机构跟投。据悉,此次融资将主要用于加速新冠疫苗研发,建设疫苗产业基地,进一步扩充产品管线。
2021年7月1日,艾博生物宣布建成了中国首个符合GMP标准的mRNA疫苗生产基地。据了解,该基地位于桑田岛区域B村二期18号楼,预计年产能将达到4000万人份单剂。

▲ 艾博生物中国首个符合GMP标准的mRNA疫苗生产基地
2021年7月15日,艾骞生物科技(北京)有限公司成立。
2021年8月,艾博生物完成7.2亿美金C轮融资。本轮融资由淡马锡(Temasek)、景顺发展市场基金(Invesco Developing Markets Fund)、正心谷资本、高瓴创投、云锋基金、礼来亚洲基金(LAV)、博裕投资共同领投,优山资本、高榕资本、晨壹投资、Octagon Capital、Kaiser、五源资本、和玉资本、雅惠投资、盈科资本、泰欣资本、AIHC瓴健、瑞华资本、Oriental Spring、君联资本跟投,现有股东启明创投、弘晖资本、人保资本股权、博远资本、CTS Capital等继续加持。
2021年11月,艾博生物获得新冠mRNA疫苗《药品生产许可证》;为江苏省首张mRNA疫苗生产许可证。
2021年11月29日,艾博生物宣布完成3亿美元的C+轮融资。本轮融资由软银愿景基金联合原股东五源资本共同领投,Chimera Abu Dhabi、富海成长基金、金镒资本、新风天域、IMO Ventures、未来资产集团、DNE资本等跟投。本轮融资将支持艾博生物加速新冠mRNA疫苗产品的临床开发和国际化步伐,结合人工智能等跨界技术,进一步提升mRNA平台的研发竞争力,快速扩充临床管线,扩大产能,全面提速商业化布局。

药融云数据(www.pharnexcloud.com)显示,艾博生物另一款带状疱疹mRNA疫苗(gE Protein)也将申报临床试验IND。此外数据监测显示,艾博生物及相关方投资的企业有:臻知医学(细胞治疗)、Kactus Biosystems等。


▲苏州艾博生物创始人兼首席执行官英博博士
03
我们也期待艾博生物做出更多的mRNA相关药物,做到国际上去。药融云数据(www.pharnexcloud.com)显示,国内在开发mRNA药物的企业有:南京奥罗生物科技有限公司(远大旗下)、斯微生物、启辰生生物科技有限公司、从Strand Therapeutics引进新药及技术平台的百济神州、嘉晨西海、苏州圣诺、深信生物、峨巍医药、广州锐博生物、蓝鹊生物、本导基因、厚存纳米、珠海丽凡达(被艾美疫苗收购)、瑞吉生物、Rinuagene、美诺恒康生物、新合生物、迈科康生物、鼎新基因、深圳近邻生物、荣灿药业、佑嘉医药等等。
参考:
NMPA/CDE;
药融云数据 www.pharnexcloud.com;
FDA/EMA;
http://www.abogenbio.com/index.html;
https://doi.org/10.1016/S2666-5247(21)00280-9;
https://doi.org/10.1016/j.cell.2020.07.024
https://www.nature.com/articles/s41392-021-00861-4;
拳拳向党心 悠悠赤子情②|英博:用“新侨”的责任和担当书写中国mRNA的历史;
Biobay;等等。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论