1.1.1总体概况
根据摩熵数据统计,2024.12.30-2025.01.05期间共有79个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号59个,进口药品受理号20个。
本周共计45款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药20款,生物药25款,无中药。其中值得注意的有:
(1)ART-101注射液
12月31日,CDE官网公示:昂拓生物的ART-101注射液获得临床试验默示许可,用于治疗高血压。公开资料显示,ART-101注射液是该公司自主研发的siRNA药物,通过靶向抑制肝脏AGT mRNA的表达,减少AGT蛋白生成,进而实现降压效果。AGT是肾素-血管紧张素-醛固酮系统(RAAS)中最上游的前体,血液循环中的AGT主要来自于肝脏,抑制AGT的产生可有效阻断RAAS系统,调控血压。
(2)HB-002.1T注射液
1月2日,CDE官网公示:华海药业的HB-002.1T注射液获得临床试验默示许可,本品与HB0028注射液联合用药,用于晚期实体瘤的治疗。公开资料显示,HB-002.1T注射液为VEGFR1第二个膜外Ig样结构域保留若干侧翼序列直接和IgG1的Fc段融合蛋白,以血管内皮生长因子(vascular endothelial growth factor receptor, VEGFR)为靶点,可阻断其生物学活性。。
(3)MRX-5片
12月31日,CDE官网公示:盟科药业的MRX-5片获得临床试验默示许可,用于治疗对本品敏感的非结核分枝杆菌引起的感染。公开资料显示,MRX-5片是一种新型苯并硼唑类抗生素,属于新型抗耐药NTM感染新药,对常见的NTM具有良好的抗菌活性,且在动物试验和人体试验中均显示出良好的安全性和药代动力学特性。此外,MRX-5具有相互作用少、不易耐药、可口服的特点,适用于长期服用以治疗慢性感染。
本周共4款新药获批上市,即来那帕韦片、来那帕韦注射液、塔戈利单抗注射液和注射用佐妥昔单抗。
1月2日,国家药监局发布药品批准证明文件送达信息:吉利德的那帕韦片和来那帕韦注射液获批上市,用于与其他抗反转录病毒药物联合使用,治疗当前方案无法达到病毒学抑制的多重耐药1型人类免疫缺陷病毒(HIV-1)感染的成人患者。公开资料显示,那帕韦是一款HIV-1衣壳抑制剂,将为对现有疗法无有效应答的HIV感染者提供一种每年仅需给药两次的全新治疗方案,主要是通过破坏艾滋病病毒的衣壳,使病毒复制不能完成。这个药物在体内代谢很慢,有效治疗浓度可以维持长达26周。
1月2日,国家药监局发布药品批准证明文件送达信息:科伦博泰的塔戈利单抗注射液获批上市,单药用于既往接受过二线及以上化疗失败的复发或转移性鼻咽癌患者的治疗。公开资料显示,塔戈利单抗注射液是一种人源化IgG1κ亚型单克隆抗体,可特异性结合细胞程序性死亡配体-1(PD-L1),阻断其与程序性死亡受体-1(PD-1)之间的相互作用,从而解除肿瘤细胞通过PD-1/PD-L1通路对T细胞的抑制作用,使免疫细胞重新发挥抗肿瘤细胞免疫作用。
1月2日,国家药监局发布药品批准证明文件送达信息:Astellas Pharma Europe B.V.的注射用佐妥昔单抗获批上市,联合含氟尿嘧啶类和铂类药物化疗用于CLDN18.2阳性、人表皮生长因子受体2(HER2)阴性的局部晚期不可切除或转移性胃或胃食管交界处(GEJ)腺癌患者的一线治疗。公开资料显示,注射用佐妥昔单抗是一种抗claudin 18剪接变体2(CLDN18.2)人鼠嵌合IgG1单克隆抗体,可特异性与CLDN18.2结合,诱导产生抗体依赖性细胞毒作用(ADCC)和补体依赖性细胞毒作用(CDC)。该品种的上市为相关患者提供了新的治疗选择。
1.1.2本周获批临床创新药/改良型新药信息速览(不含补充申请)
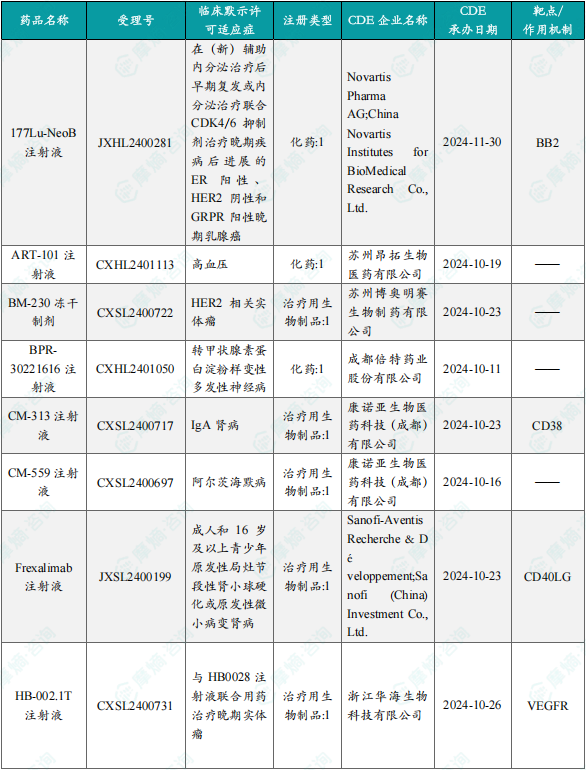
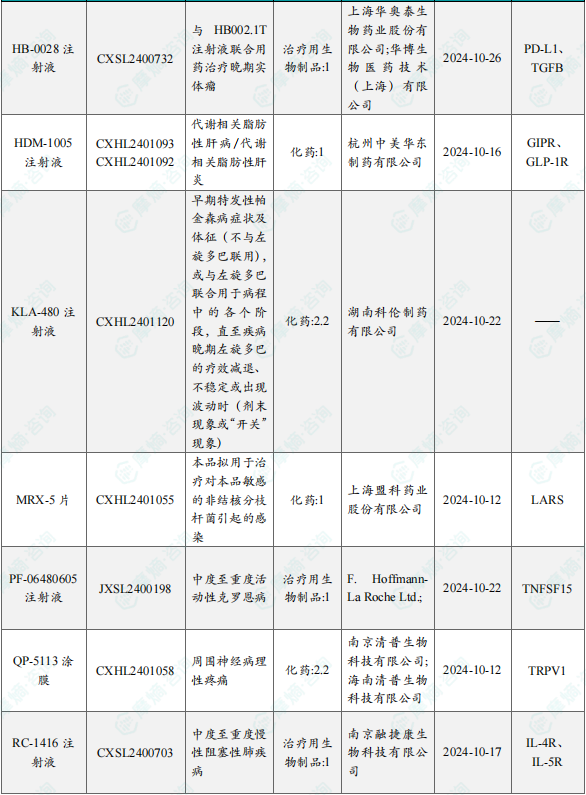
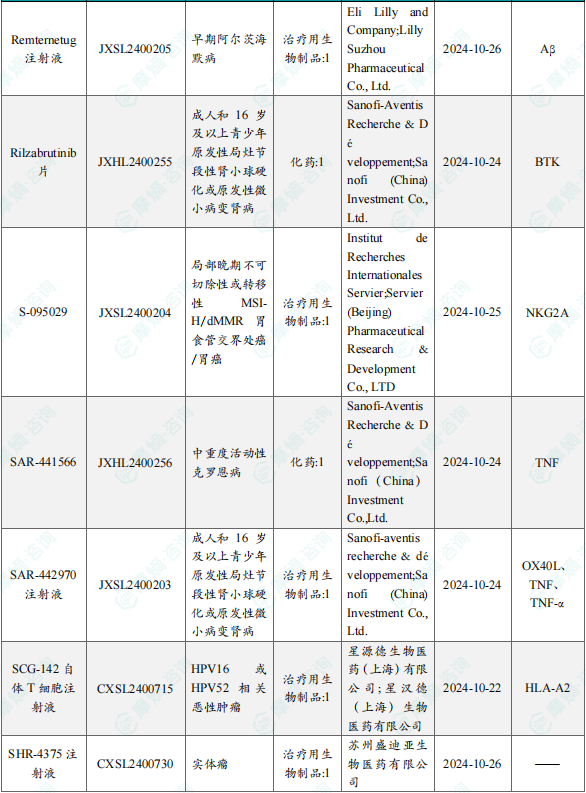
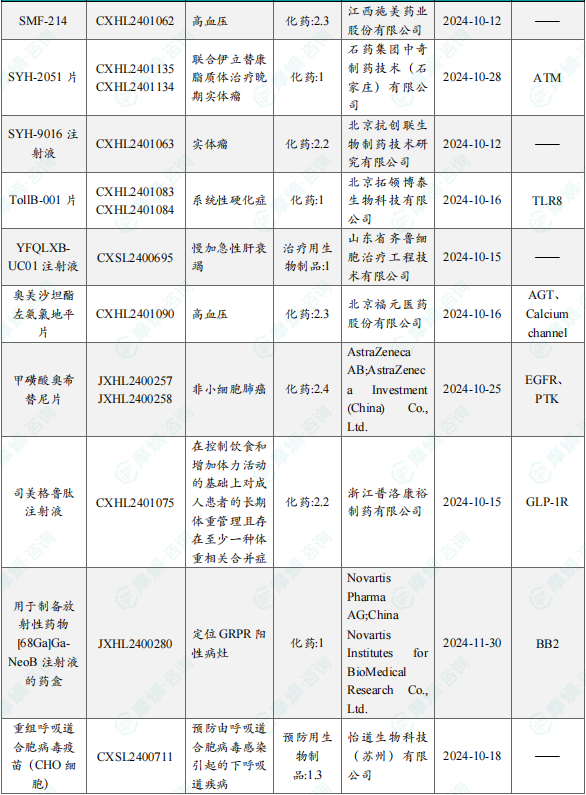

备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵中国药品审评数据库获取并下载EXCEL表格。
1.1.3本周获批上市创新药信息速览


备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵数据库获取并下载EXCEL表格。
同期事件:
1. 2025年第1周12.30-01.05国内仿制药/生物类似物申报/审批数据分析
2. 2025年第1周12.30-01.05国内医药大健康行业政策法规汇总
3. 2025年第1周12.30-01.05全球医药大健康行业投融资数据
4. 2025年第1周12.30-01.05全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2024.12.30-2025.01.05)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论