
科济药业是一家在中国及美国拥有业务的生物制药公司,专注于治疗血液恶性肿瘤和实体瘤的创新CAR-T细胞疗法。科济药业建立了从靶点发现、临床前研究、产品临床开发到商业规模生产的CAR-T细胞研究与开发的端到端能力。科济药业通过自主研发新技术以及拥有全球权益的产品管线,产品管线包括升级版的全人源靶向BCMA CAR-T,全球唯一获得IND临床试验许可的全球潜在同类首创Claudin18.2 CAR-T, 以及全球潜在同类首创的GPC3 CAR-T。
近日,科济药业公布了2024年中期业绩及其最新管线更新情况:
一、2024上半年业绩
科济药业2024年中期报告中披露:报告期内,公司实现收入约人民币600万元,主要来源于其核心产品赛恺泽®(泽沃基奥仑赛注射液,研发代号:CT053)的销售。
然而,公司净亏损约为人民币3.52亿元,尽管较去年同期的约人民币4.04亿元有所减少。管理层认为,该减少主要由于(i)以股份为基础的薪酬减少,截至2024年6月30日止六个月总计约为人民币900万元,较截至2023年6月30日止六个月的约人民币1900万元减少约人民币1000万元;(ii)研发开支减少;及(iii)截至2024年6月30日止六个月确认收益约人民币600万元,之前并无录得任何收益。
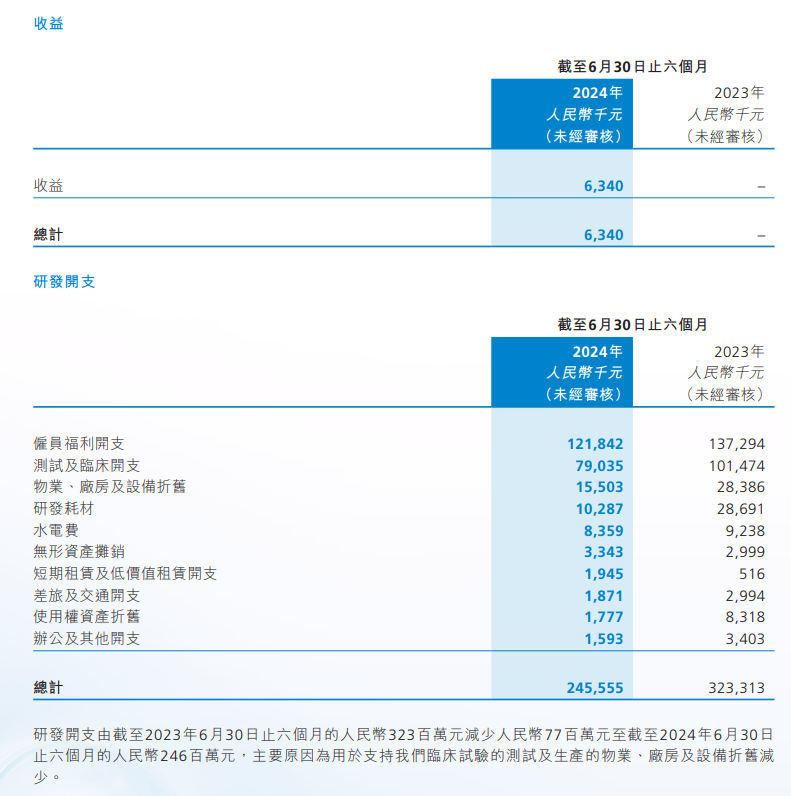
截至2024年6月30日,现金及银行结余约为人民币16.53亿元,相较截至2023年12月31日的约人民币18.5亿元减少约人民币1.97亿元。该减少主要是由于研发开支、行政开支及资本开支投入所致。于2024年末的现金及现金等价物及存款预期将不少于人民币13.5亿元。不考虑后续的现金流入的前提下,预期将有充足现金进入2027年。
截至2024年6月30日,公司共有477名员工。

二、研发管线
截至2024年6月30日,科济药业已自主研发了9款差异化候选产品,涉及BCMA、Claudin18.2、GPC3等多个热门靶点,适应症涵盖血液肿瘤和实体肿瘤,其核心产品赛恺泽已在中国获批上市,适应症复发或难治性多发性骨髓瘤,此外还有12条管线处于临床阶段。公司拥有超过300项专利,其中有114项为全球(包括中国、美国、欧洲及日本)授权专利。相较2024年1月1日,增加了10项授权专利及10项专利申请。

公司核心产品赛恺泽®(泽沃基奥仑赛注射液,研发代号:CT053)
· 赛恺泽是一种用于治疗R/R MM的全人源自体BCMA CAR-T细胞产品。其融合了具有低免疫原性和较高稳定性的全人源BCMA特异性单链可变片段(scFv)的CAR结构,在没有肿瘤相关靶点的情况下,可降低CAR-T细胞的自我激活,克服了T细胞耗竭的问题。
· 科济药业于2024年3月1日收到NMPA的通知,批准赛恺泽®新药上市申请(批准日期2024年2月23日),用于治疗R/R MM成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
· 这是科济药业于中国大陆地区商业化的首款产品。于2023年1月,科济及华东医药(杭州)有限公司就在中国大陆地区商业化赛恺泽®的独家权利签订协议。除首付款人民币200百万元外,科济药业已收取监管里程碑付款人民币75百万元。根据协议条款,科济有权获得最高不超过人民币1,025百万元的注册及销售里程碑付款。科济继续负责赛恺泽®在中国大陆地区的开发、注册及生产。
· 在商业化落地方面,华东医药已组建独立专业、全方位的商业化团队全面推广赛恺泽®,已利用中国多层次保险体系,提高患者可及性。截至2024年7月31日,赛恺泽®被纳入近20个省或市的惠民保及商业保险,完成认证及备桉的医疗机构覆盖全国19个省市、数量超过100家,我们共计从华东医药获得52份订单。
舒瑞基奥仑赛注射液-人源化Claudin18.2 CAR-T
· 舒瑞基奥仑赛注射液是一种全球潜在同类首创的、靶向Claudin18.2蛋白的自体CAR-T细胞产品。舒瑞基奥仑赛注射液用于治疗Claudin18.2阳性实体瘤,主要治疗GC/GEJ及PC。Claudin18.2在一系列实体瘤中表达,包括GC/GEJ、PC、结直肠癌、肺癌和卵巢癌。
· 为了进一步解决CAR-T细胞疗法治疗实体瘤的挑战,科济药业针对舒瑞基奥仑赛注射液开发了一种受专利保护的创新性清淋预处理方案(FNC)。该方案的特点是在包括环磷酰胺和氟达拉滨的传统清淋方案基础上加入低剂量的白蛋白结合型紫杉醇。根据临床试验方桉,在中国进行的用于GC/GEJ患者的确证性II期临床试验(CT041-ST-01, NCT04581473)的入组工作已经完成。科济计划于2025年上半年在中国向NMPA提交NDA。
· 科济药业已开始进行舒瑞基奥仑赛注射液用于早线治疗的相关试验:包括一项正在中国进行的针对PC辅助治疗的I期临床试验(CT041-ST-05,NCT05911217)及一项正在启动的用于根治术后的GC/GEJ患者辅助治疗后的巩固治疗的研究者发起的临床试验。
CT011-人源化GPC3 CAR-T
· CT011是一种自体CAR-T细胞产品,已积累一定的治疗肝细胞癌(HCC)的概念验证性临床数据。科济药业联合创始人、首席执行官和首席科学官李宗海博士领导了全球首次成功识别、验证和报告GPC3作为肿瘤相关靶点用于开发CAR-T细胞产品治疗HCC的相关工作。
· 2024年1月,CT011获得NMPA的IND批准,用于治疗手术切除后出现复发风险的GPC3阳性的IIIa期肝细胞癌患者。
· 2023年7月,一篇题为「CAR-GPC3 T细胞联合局部治疗用于晚期肝细胞癌:一种概念验证性治疗策略」 (”Combined local therapy and CAR-GPC3 T-cell therapy in advanced hepatocellular carcinoma: a proofof-concept treatment strategy“)的文章发表在《Cancer Communication》上。文章报道了2例于局部治疗 后序贯GPC3 CAR-T细胞治疗的晚期HCC患者,均获得了7年以上的无病生存期。
CT071-GPRC5D CAR-T
· CT071是一种通过科济专有CARcelerate®平台开发的靶向GPRC5D的自体CAR-T细胞治疗产品,含有科济开发的全人抗单链可变片段(scFV),用于治疗R/R MM及R/R pPCL。科济的专有CARcelerate®平台可将CT071的制造时间缩短至30小时左右,从而製造出比传统生产方法更年轻且可能更强效的CAR-T细胞。生产效率的提升也进一步增强供应产能、降低生产成本,提高患者对产品的可及性。
· 研究者发起的针对R/R MM及R/R PCL的临床试验(NCT05838131)的结果在2024年6月举行的第29届EHA年 会上以壁报形式展示,标题为「快速生产的靶向GPRC5D的CAR-T细胞产品(CT071)在复发╱难治性多发性 骨髓瘤患者中的首次人体研究」(“First-in-human study of GPRC5D-targeted CAR T cells (CT071) with an accelerated manufacturing process in patients with relapsed/refractory multiple myeloma (RRMM)”)。进一步数据更新计划于2024年下半年发布。
· 另一项研究者发起的治疗新诊断的多发性骨髓瘤(NDMM)的临床试验(NCT06407947)正在中国进行。CT071已于2023年11月获得FDA的IND批准用于治疗R/R MM及R/R pPCL。由于RTP生产工厂存在CMC相关问题,CT071在美国的1期临床试验已被FDA要求暂停。
IND申报准备或临床前阶段产品
除上述临床阶段候选产品外,科济药业有多个处于IND申报准备或临床前阶段的项目。
CT048为一种利用其CycloCAR®技术开发的下一代自体CAR-T细胞候选产品,用于治疗Claudin18.2阳性GC/GEJ及PC患者。通过共表达细胞因子IL-7和趋化因子CCL21,预期CT048可能展现出更好的临床疗效,并潜在可降低对清淋预处理的需求。目前正在中国进行一项研究者发起的临床试验,旨在评估CT048治疗GC/GEJ及PC的安全性和疗效。CT0590是一种利用我们的THANK-uCAR®技术靶向BCMA的同种异体CAR-T细胞候选产品。我们在中国已经 启动一项研究者发起的临床试验,旨在评估CT0590治疗R/R MM的安全性和疗效。公司计划于2024年下半年披露概念验证研究结果。
KJ-C2114为一种利用科济药业THANK-uCAR®技术靶向未披露靶点的同种异体CAR-T细胞候选产品,用于治疗若干实体瘤。
KJ-C2219为一种靶向CD19/20的同种异体CAR-T细胞产品,用于治疗血液恶性肿瘤及自身免疫性疾病。
KJ-C2320为一种同种异体CAR-T细胞产品,用于治疗急性髓系白血病。公司将于2024年下半年在中国启动一项研究者发起的临床试验。
三、技术平台
公司已建立一个涵盖整个CAR-T开发周期的综合研发平台,包括靶点发现、抗体开发、载体设计、制造、质量保证以及质量控制。公司的综合细胞疗法平台由靶点发现、杂交瘤和抗体人源化平台、全人源噬菌体展示抗体库平台、抗体识别平台、免疫细胞功能评估平台、质粒和慢病毒载体制备平台、细胞治疗流程开发平台、以及具备分子、流式细胞仪、生化、物理化学及细胞分析能力的分析平台、生物样本检测平台、临床规模及商业规模的CAR-T制造平台及临床研究平台组成。
尽管已有多款用于血液恶性肿瘤末线治疗的CAR-T细胞产品获批,但仍面临重大挑战,如对实体瘤的疗效有限、不良安全问题以及高昂的生产和治疗成本。科济药业致力于探索及开发创新技术平台,以应对该等挑战,为全球癌症患者生产更好的细胞疗法产品。公司将持续投身于推进技术创新,以攻克CAR-T行业仍在面临的挑战:
(一)增强实体瘤疗效的下一代技术:CycloCAR
CycloCAR-T(Cytokine and Chemokine Loaded CAR,细胞因子和趋化因子负载的嵌合抗原受体),通过设计表达细胞因子IL-7(白介素-7)和趋化因子CCL21,有望显著增强针对实体瘤CAR-T细胞的疗效。T细胞的募集、存活和增殖是CAR-T细胞疗法在实体瘤治疗中的重要限制。IL-7 作为一种细胞因子,可以增强CAR-T细胞的增殖和存活,而 CCL21作为一种趋化因子,可以驱动淋巴细胞和树突状细胞募集到肿瘤部位。CycloCAR-T细胞还可以抑制具有异质抗原表达的肿瘤组织的生长,甚至可以诱导肿瘤的完全缓解。从机制上讲,IL-7和CCL21显著改善了肿瘤中CAR-T细胞和树突状细胞的存活和浸润。此外,免疫组化证实CCL21还可以抑制肿瘤的血管生成。

(二)同种异体CAR-T平台:THANK-uCAR
为了降低成本及增加CAR-T细胞疗法的可及性,科济药业继续开发具市场差异化的同种异体THANK-uCAR®技术。THANK-uCAR®为公司的专有技术,通过修饰供体来源的T细 胞,产生具有更好扩增和持久性的同种异体CAR-T细胞。
为了尽可能减少同种异体T细胞的移植物抗宿主病(GvHD)和宿主抗移植物反应(HvGR),其破坏了编码TCR和β2微球蛋白(B2M)的基因组位点,以 消除TCR或人类白细胞I类抗原(HLA-I)的表面表达,这种方法已经被先前的研究所验证。然而,由于自然杀伤(NK)细胞会攻击没有HLA-I表达的T细胞,进而限制了同种异体CAR-T细胞的扩增和持久性。
为 了保护同种异体CAR-T细胞免受患者NK细胞的攻击,公司将一种识别NKG2A的CAR装载到TCR-/HLAI-T细胞中,以阻止NKG2A阳性NK细胞对CAR-T细胞的排异,从而使THANK-uCAR-T细胞抵抗NK细胞的攻击。体外和体内研究表明,将抗NKG2A CAR装载到TCR-/HLA-IT细胞中,使NK细胞能更好地扩增。我们正在开发使用THANK-uCAR®技术的同种异体CAR-T细胞产品,我们认为该技术能够促进CAR-T细胞的扩增、持久性及疗效。

(三)精准靶向的技术平台:LADAR
LADAR®技术的目标基因的细胞内转录由一个人工受体控制,该受体在细胞内结构域中含有转录因子。一旦LADAR受体的胞外结构域与触发抗原(发送者抗原)结合,转录因子就会被切割并转移到细胞核,从而触发目标基因的表达。感兴趣的基因可能是嵌合抗原受体(CAR)、细胞因子或任何需要的治疗介质。
LADAR-CAR电路需要用于LADAR®的发送者抗原和用于CAR识别的目标抗原的同时存在,以杀死目标细胞,从而减少在同一正常组织中不同时表达这两种抗原的在靶脱瘤毒性。在体外研究中,LADAR®系统诱导了强烈的基因表达,以响应触发抗原的结合,重要的是,在没有触发抗原的情况下几乎没有泄漏表达。
公司还在研究LADARTM系统的其他应用,例如LADAR-细胞因子通路。我们相信,LADARTM系统 的建立是开发出强大而精准杀伤癌症的CAR-T细胞的关键一步。

(四)专有平台:CARcelerate®平台
科济药业开发了一个专有平台以将CAR-T细胞的制造时间缩短至约30小时。CARcelerate®平台生产的CAR-T细胞更年轻,更好地保持「原始」状态,且更有可能降低耗竭。预计来自CARcelerate®平台的CAR-T细胞将表现出更强的抗肿瘤活性。生产效率的提升也进一步增强供应产能、降低生产成本,并提高患者对产品的可及性。科济药业正在使用CARcelerate ®生产CT071,用于治疗MM或pPCL患者。
四、产能扩张
科济药业已自主建立了符合GMP的生产能力,以支持包括质粒、慢病毒载体和CAR-T细胞产品生产的垂直一体化 的CAR-T制造。垂直一体化生产有利于提高效率,加强控制,从而提高药品一致性,致力于加快患者的周转时间。一体化生产亦将有助于大幅降低成本,提高利润率,实现更有利的商业化。
除专有平台CARcelerate®,进一步提高生产效率外,公司已扩大在中国和美国的产能,以支持临床试验和随后我们的管线产品的商业化。目前,共有三个生产工厂全面投入运营,其中位于上海徐汇的生产工厂支持临床开发,位于上海金山的生产工厂和位于美国北卡罗来纳州达勒姆市的三角研究园区的生产工厂支持临床开发和商业化生产。
凭借在上海徐汇的临床生产工厂和上海金山的商业化生产工厂,公司可以自主生产慢病毒载体及CAR-T细胞,以支持在中国的临床试验和未来的CAR-T细胞商业化。公司还为中国境外的临床试验生产慢病毒载体。科济药业在上海徐汇区的临床生产工厂总建筑面积约为3,000平方米,CAR-T年产能可支持200名患者的CAR-T细胞治疗,已用于CAR-T细胞产品的临床生产,以支持主要资产的多项临床研究。自成立以来,徐汇工厂 的所有产品的生产成功率已超过95%。公司还完成了位于上海金山区的商业化规模生产工厂的建设,总建筑面积约为7,600平方米,估计产能可支持每年最多2,000名患者的CAR-T细胞治疗。金山生产工厂通过了上 海市药品监督管理局(上海药监局)的现场检查,获发中国第一张CAR-T细胞疗法的药品生产许可证(「生产许可证」)。
参考来源:科济药业2024年中期业绩
<END>
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论