
在生物医药领域,CGT疗法不断取得突破,为众多疑难病症的治疗带来新希望。CGT疗法已覆盖血液肿瘤、实体瘤及罕见病等多种疾病领域,在血液肿瘤领域,CAR-T 细胞疗法表现突出;对于实体瘤治疗也有一定突破,如 TCR-T 疗法等;在非肿瘤适应症方面,可应用于烧伤、软骨损伤、B 型血友病、β- 地中海贫血、镰状细胞病等。
2024年CGT疗法获批情况:
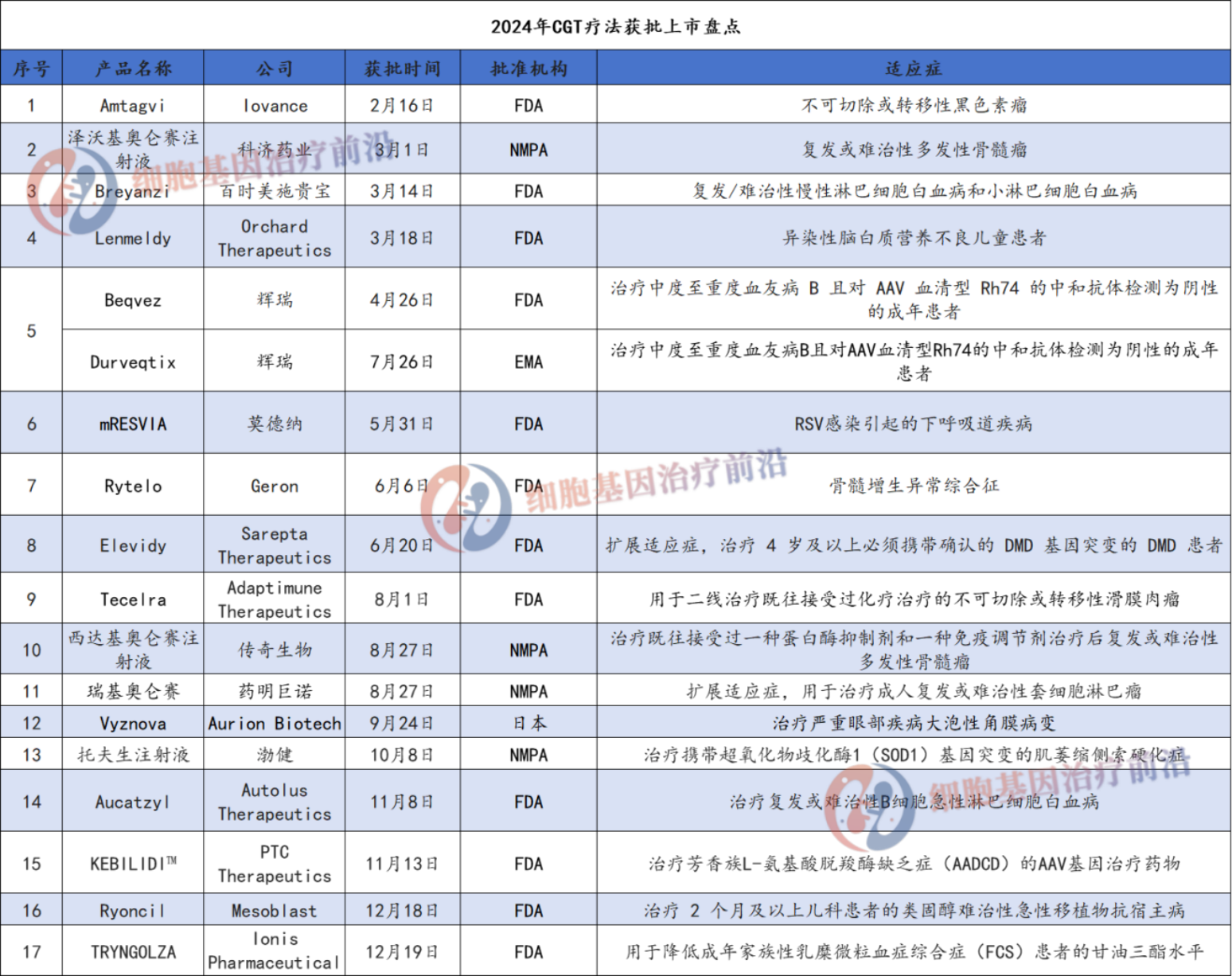
据不完全统计,2024年全球共17款CGT疗法获批。国外占大多数,国内也有4款CGT产品获批上市,分别是:科济药业的“泽沃基奥仑赛注射液”,传奇生物的“西达基奥仑赛注射液”,药明巨诺的“瑞基奥仑赛”,渤健的“托夫生注射液”。另外15款获批产品中有2款是扩展适应症,分别是:药明巨诺的“瑞基奥仑赛”和Sarepta Therapeutics的“Elevidy”。
这些获批成果不仅是生物医药企业研发实力的证明,更标志着医学在攻克复杂疾病道路上的重大进展。
1. 科济药业
3月1日,科济药业(股票代码:2171.HK)发布公告:国家药品监督管理局(“NMPA”)已批准其BCMA CAR-T产品赛恺泽®(泽沃基奥仑赛注射液)新药上市申请(“NDA”),用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
赛恺泽®是一种自体BCMA靶向CAR-T细胞产品,它是通过慢病毒转导T细胞产生的。慢病毒编码的CAR包括全人源BCMA特异性单链可变片段(“scFv”),人CD8α铰链结构域、CD8α跨膜结构域、4-1 BB协同刺激结构域以及CD3ζ激活结构域。自研的新全人源scFv具有较高的结合亲和力和稳定性。


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论