
近日,眼科细胞疗法研发商Aurion Biotech宣布美国FDA授予其同种异体细胞疗法AURN001突破性疗法认定(BTD)和再生医学先进疗法(RMAT)认定,用于角膜内皮疾病继发的角膜水肿。
据悉,AURN001是同时获得美国FDA的BTD与RMAT认定的首个同种异体细胞疗法。

Aurion Biotech是一家美国眼科细胞疗法研发商,其首款在研细胞疗法针对的是由于角膜内皮功能失调而导致的角膜水肿。Aurion公司从京都府立医科大学的Shigeru Kinoshita教授课题组获得了一款细胞疗法的授权。这一创新疗法能在体外扩增角膜内皮细胞,再将这些健康细胞注射到患者的角膜内。
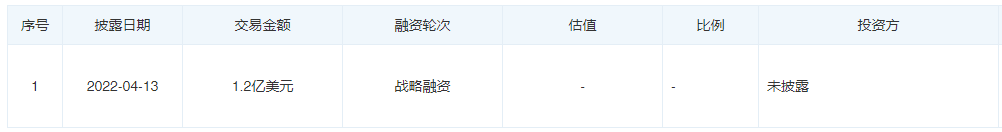
融资历程
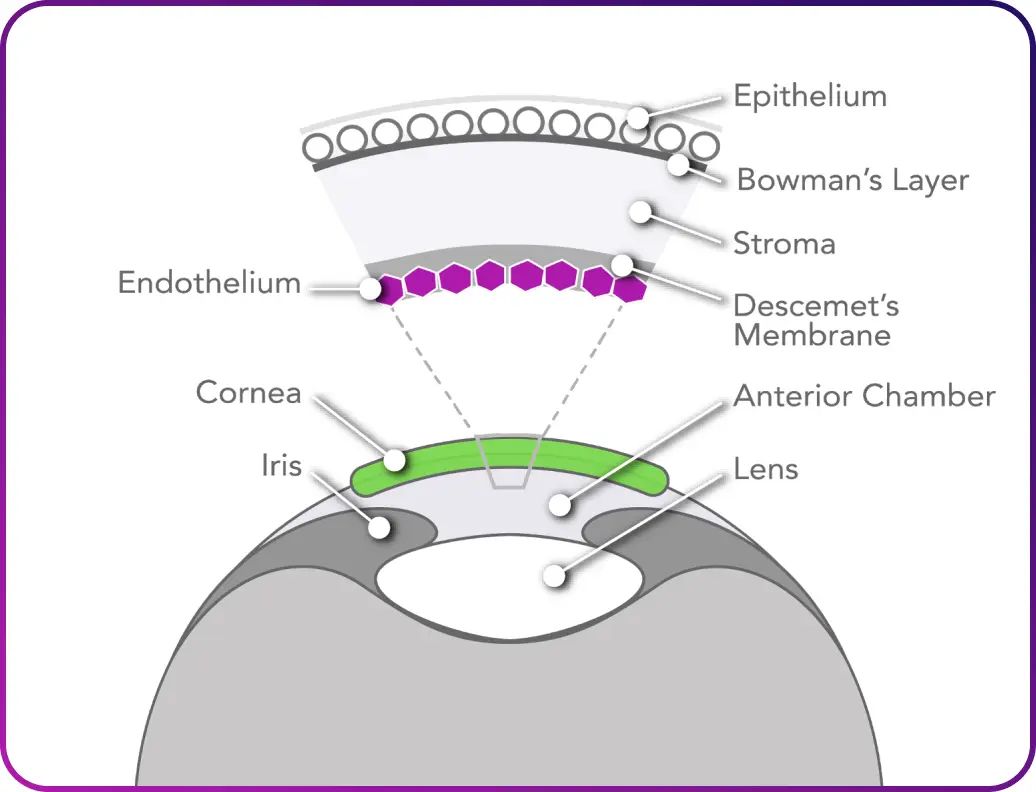
角膜内皮疾病是一种影响视力衰弱性疾病,影响着全世界数百万人。角膜内皮细胞无法再生,一旦这些细胞死亡,它们就会永远消失。角膜内皮疾病会导致视力模糊、眩光等不适,甚至出现剧烈疼痛。
虽然局部治疗可以缓解早期疾病症状,但对于更严重的角膜内皮功能障碍,唯一的治疗方法是角膜移植。该手术存在术后恢复困难和并发症的风险。
而AURN001是一种一次性前房注射细胞疗法与药物的组合,由同种异体人角膜内皮细胞neltependocel和Rho相关蛋白激酶(ROCK)抑制剂Y-27632所组成。该细胞疗法治疗创伤性极小,可以快速地进行,患者的恢复期仅需 2 ~ 3 小时。
目前,Aurion已在美国和加拿大完成AURN001 1/2期CLARA试验的招募和患者给药。
AURN001各国研发进度

同种异体细胞疗法,又被称为“现货型“或“通用型”细胞疗法。近期该领域也迎来不少积极报道。
前不久,T细胞免疫治疗领域领导者Atara Biotherapeutics向美国FDA提交了tabelecleucel(tab-cel)的生物制品许可申请(BLA),作为爱泼斯坦-巴尔病毒(EBV)阳性的移植后淋巴增殖性疾病(PTLD)单药疗法,用于至少接受过一次治疗的成人以及两岁以上儿科患者。如果tab-cel获批,将成为全球首款同种异体T细胞免疫疗法,以及治疗EBV阳性PTLD的首款疗法。
放眼国内,布局该领域的公司有传奇生物、亘喜生物、科济生物、茂行生物、济因生物、晨泰医药等。其中传奇生物是中国CAR-T海外上市第一股。它拥有同种异体细胞疗法平台,利用基因编辑开发同种异体CAR-T疗法。基于该平台,传奇生物开发出靶向CD20的异体CAR-T细胞治疗产品LUCAR-20S。LUCAR-20S 的1期研究已启动,初步资料显示 LUCAR-20S 输注后具有抗肿瘤活性。
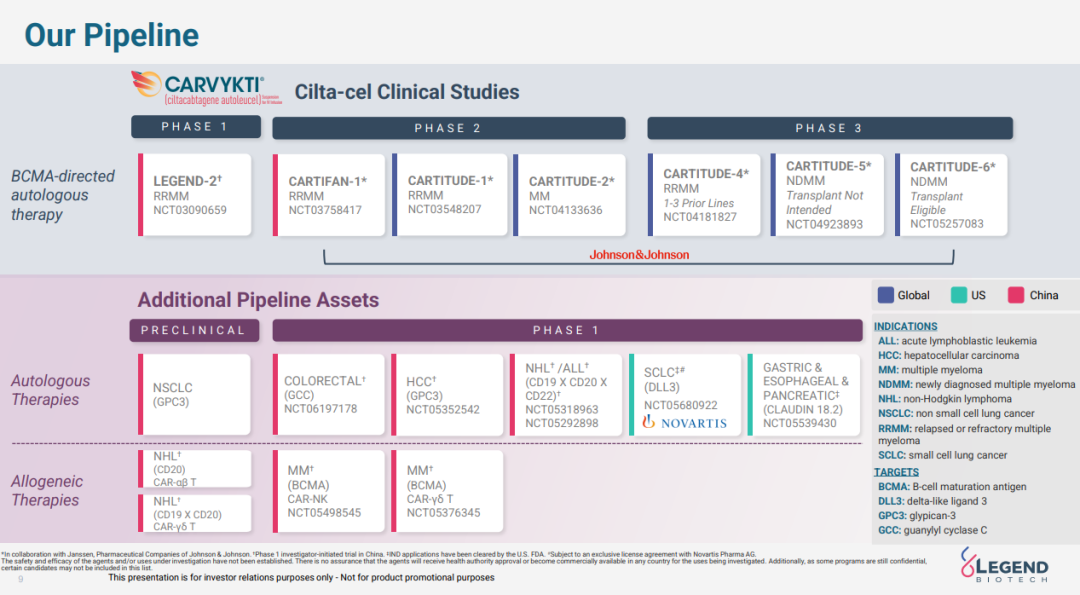
研发管线
参考资料:
https://aurionbiotech.com/aurion-biotech-receives-breakthrough-therapy-designation-and-regenerative-medicine-advanced-therapy-designation/
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论