
6月10日,阿斯利康宣布奥希替尼(Tagrisso)治疗放化疗(CRT)后不可切除的EGFR突变型(外显子19缺失或外显子21(L858R)突变)III期非小细胞肺癌(NSCLC)患者的补充新药申请(sNDA)获FDA受理并予以优先审评。

奥希替尼是阿斯利康开发的三代EGFR抑制剂,于2015年11月首次在美国获批上市。截至目前,该药物已获批4项适应症:
1. 单药一线治疗外显子19缺失或外显子21(L858R)突变的局部晚期或转移性NSCLC患者;
2. 接受EGFR-TKI治疗期间或之后出现进展的EGFR T790M突变阳性局部晚期或转移性NSCLC患者;
3. 辅助治疗手术切除后的外显子19缺失或外显子21(L858R)突变的NSCLC患者;
4. 联用培美曲塞和铂类化疗一线治疗外显子19缺失或外显子21(L858R)突变的局部晚期或转移性NSCLC患者。
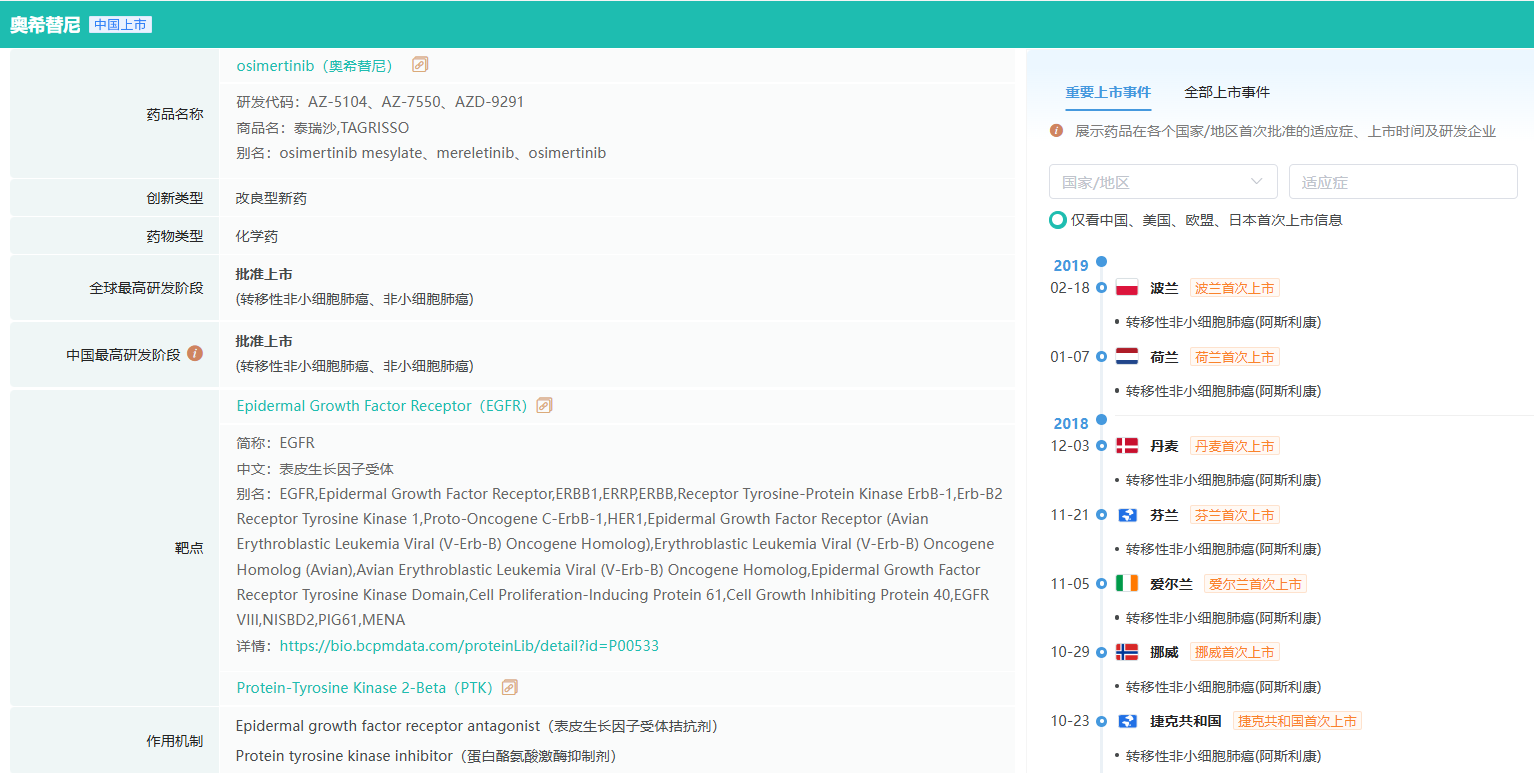
截图来源:药融云全球药物研发数据库
研究显示,奥希替尼治疗组的无进展生存期(PFS)显著超越安慰剂组,达到了39.1个月,而安慰剂组仅为5.6个月(HR=0.16,P<0.001)。在治疗的第12个月时,奥希替尼组中有高达74%的患者疾病未进展且存活,而安慰剂组仅为22%。经过36个月的观察,奥希替尼组和安慰剂组的生存率分别为84%和74%(HR=0.81,P=0.53,数据成熟度为20%)。

BICR评估的PFS
在安全性方面,奥希替尼组有35%的患者报告了3级及以上的不良事件,相比之下,安慰剂组仅为12%。尽管奥希替尼组中48%的患者报告了放射性肺炎(主要为1-2级),但这一比例在安慰剂组中也达到了38%。值得注意的是,奥希替尼在研究中并未发现新的安全性问题。
如果此适应症获得批准,TAGRISSO将适用于携带 19 号外显子缺失(19del)或 21 号外显子(L858R)突变的EGFRm患者。TAGRISSO最近还获得了FDA的突破性疗法认定(BTD)。
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论