
据不完全统计,2024年1-2月已有18款CGT疗法获批IND,CAR-T疗法的药物成为获批上市的CGT药物中的主流。获批的药物中包括11款细胞产品、5款基因治疗产品和2款siRNA药物。小编整理如下:

康霖生物
2024年1月3日,康霖生物科技(杭州)有限公司自主研发的KL003细胞注射液成功获得中国国家药品监督管理局(NMPA)的临床试验默示许可。

KL003细胞注射液是一款基因修饰自体造血干细胞产品,临床上用于治疗成人或儿童输血依赖型β-地中海贫血。该产品通过慢病毒载体介导的β-globin基因转导自体造血干细胞并回输,在患者体内分化出表达功能正常的β-globin的红细胞,恢复患者血红蛋白水平,从而摆脱输血依赖,达到一次性功能性治愈的效果。
百吉生物
2024年1月15日,据CDE官网公布,百吉生物第三条全球独家首创产品管线BRL03注射液新药临床试验获批,用于治疗多种晚期实体瘤,包括肺癌和胃癌等。
去年9月9日,美国FDA批准了BRL03的I/II期临床试验申请,BRL03注射液的NMPA IND申请获得批准,标志着百吉生物已正式获得第7个全球首创产品的IND临床批件。作为百吉生物自主研发的首款进入临床的TCR-T产品,IIT研究显示BRL03注射液在实体瘤治疗中具有良好的安全性和初步疗效。
研发管线

凌意生物
2024年1月16日,凌意(杭州)生物科技有限公司(以下简称“凌意生物”)自主研发的I类治疗用生物制品LY-M001注射液的新药临床试验(Investigational New Drug,IND)申请顺利获得国家药品监督管理局(NMPA)的默示许可(受理号为:CXSL2300730)。
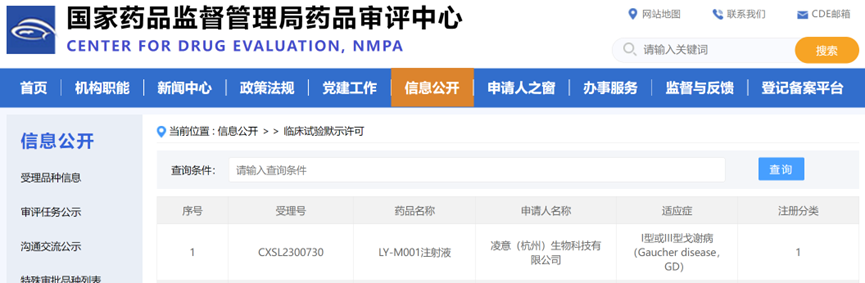
LY-M001注射液是中国首个自主研发,针对I型或III型戈谢病的AAV基因治疗药物。该产品使用重组腺相关病毒rAAV为载体,通过单次静脉输注给药后即可表达患者所需的葡萄糖脑苷脂酶。凌意生物开发了拥有完全自主知识产权的改良型葡萄糖脑苷脂酶基因治疗载体,可在体内长期稳定表达并降解有害糖脂代谢物,从而达到长期治疗戈谢病的目标。
研发管线
恩凯赛药
2024年1月17日,由上海恩凯细胞技术有限公司(恩凯赛药)独立自主研发的非基因修饰自然杀伤细胞注射液(项目代号NK010)获得美国食品药品监督管理局(FDA)I期临床试验(IND)许可。目前,该产品为国内首个获得FDA批准的非基因修饰异体外周血NK细胞药物。

NK010具有受体谱最优化、靶点多样化、高纯度、普适性等高抗癌优势,使其具有治疗多类型肿瘤的潜力。NK010也存在扩展至非肿瘤疾病治疗的潜在空间,还是后续一系列合成NK细胞药物(SynNK)的最佳底盘细胞。此次I期临床首选卵巢癌适应症进行探索,临床前研究表明,NK010细胞注射液在卵巢癌、肝癌等实体肿瘤以及急性髓系白血病等动物模型中都表现出强大的抗肿瘤活性。
研发管线
美杰赛尔
2024年1月23日,CDE官网显示,美杰赛尔(北京)生物科技有限公司(以下简称“美杰赛尔”)的PD-1基因编辑T细胞注射液临床试验申请(IND)获批,该产品为PD-1基因敲除的自体T细胞制剂,用于18-75岁的晚期非小细胞肺癌患者。

本次获批临床默示许可的“PD-1基因编辑T细胞注射液”,是成都美杰赛尔生物科技有限公司研发、生产、并通过其全资子公司美杰赛尔生物(北京)科技有限公司向国家药监局申报的细胞一类新药,也是四川省第一个获批IND的细胞一类新药。
驯鹿生物
2024年1月25日,驯鹿生物宣布国家药品监督管理局(NMPA)审评中心(CDE)已正式审批通过其全人源靶向BCMA嵌合抗原受体自体T细胞注射液(伊基奥仑赛注射液,研发代号CT103A)新增扩展适应症难治性全身型重症肌无力的临床试验申请(IND)(受理号:CXSL2300759)。

伊基奥仑赛注射液(商品名:福可苏®)已于2023年6月30日获国家药监局批准上市,用于治疗复发难治多发性骨髓瘤,本次重症肌无力IND的获批进一步拓展了伊基奥仑赛注射液的适应症范围,这也是其继视神经脊髓炎谱系疾病(NMOSD)后获批IND的第二个自免领域适应症。驯鹿生物是国内率先将CAR-T产品用于自免适应症的公司,有望改变自免疾病的治疗格局。
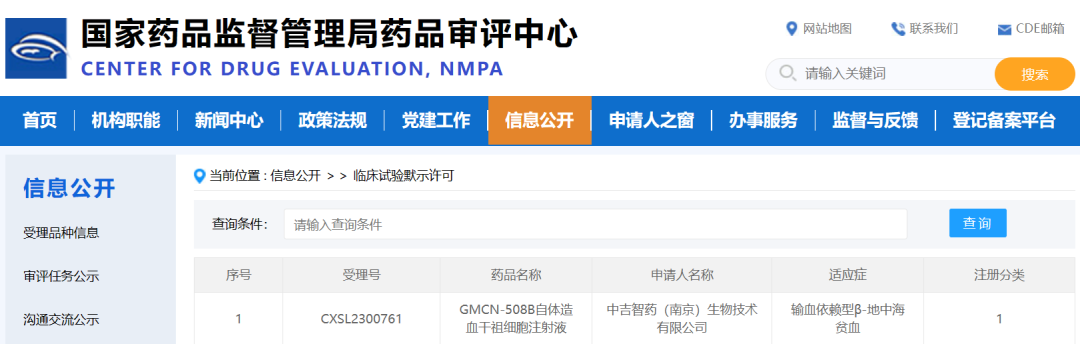
中吉智药
2024年1月26日,中吉智药申报的基因治疗β-地中海贫血药物GMCN-508B的临床试验(IND)申请,获国家药品监督管理局药品审评中心(CDE)默示许可,标志公司正式进入注册临床试验阶段。
此次IND获批,是中吉智药作为专注慢病毒载体和造血干细胞治疗领域的新兴公司,跨越了重要里程碑,标志着中吉智药已经由“科学家”,成功转身为“制药人”。
原启生物
2024年1月29日,原启生物宣布美国食品药品监督管理局(FDA)正式批准其用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者的OriCAR-017的新药临床申请(IND)。

OriCAR-017是原启生物利用自主创新技术平台开发出的一款靶向GPRC5D的嵌合抗原受体T细胞疗法(CAR-T)。该产品的设计和开发整合了原启生物自主创新的Ori®Ab抗体平台、Ori®CAR结构平台和公司在CMC方面的专识,在早期的探索性临床研究中展现了良好且持久的抗肿瘤功效,同时也展现了优异的安全性。随着本次IND获批,原启生物即将启动OriCAR-017在美国的临床开发工作。
研发管线

亘喜生物
1月30日,公司宣布美国食品药品监督管理局(FDA)正式批准了FasTCAR-T GC012F疗法的又一项新药临床试验(IND)申请,准许公司在美国启动GC012F早线治疗多发性骨髓瘤(ELMM)1期临床试验。
GC012F是一款基于亘喜生物专有的FasTCAR技术平台开发的BCMA/CD19双靶点自体CAR-T细胞疗法,有望变革性地为癌症和自身免疫性疾病治疗带来快速、深入且持久的效果,并具备差异化的安全性优势。目前,公司正在开展FasTCAR-T GC012F的多项临床研究,适应症覆盖多种血液肿瘤和自身免疫性疾病。临床数据显示,该药物在临床研究中一以贯之地展现出了卓越的有效性和安全性。公司已在美国启动了一项评估 GC012F治疗复发/难治性多发性骨髓瘤(RRMM)的1b/2期IND临床试验,在中国也即将启动同适应症的1/2期IND临床试验。此外,美国FDA和中国NMPA都已批准了GC012F针对难治性系统性红斑狼疮(rSLE)的IND申请;同时,一项针对同适应症的由研究者发起的临床试验也已启动。近日,美国FDA再次批准了GC012F早线治疗多发性骨髓瘤的IND申请。
星曜坤泽
2024年2月2日,苏州星曜坤泽生物制药股份有限公司(以下简称“星曜坤泽”)宣布其研发的乙肝新药HT-101(siRNA)的临床申请已获得美国FDA批准直接开展针对慢性乙型肝炎病毒感染的Ib期临床试验。

HT-101注射液是首个进入临床阶段的国产抗乙肝siRNA产品,已在国内完成了针对健康志愿者的全部研究以及针对慢性乙肝患者的Ib期临床所有给药,初步研究数据表明HT-101在健康人群和慢性乙肝患者中具有良好的安全性及耐受性,并且可显著降低慢性乙肝患者乙肝表面抗原(HBsAg),中高剂量组HBsAg降幅达2lg以上且无明显反弹。
中因科技
2月7日,据CDE官网公示,北京中因科技有限公司研发的“ZVS203e 注射液”获得临床试验默示许可,用于治疗携带RHO-R135W(RHO c.403C>T)突变的视网膜色素变性(Retinitis Pigmentosa, RP)患者。
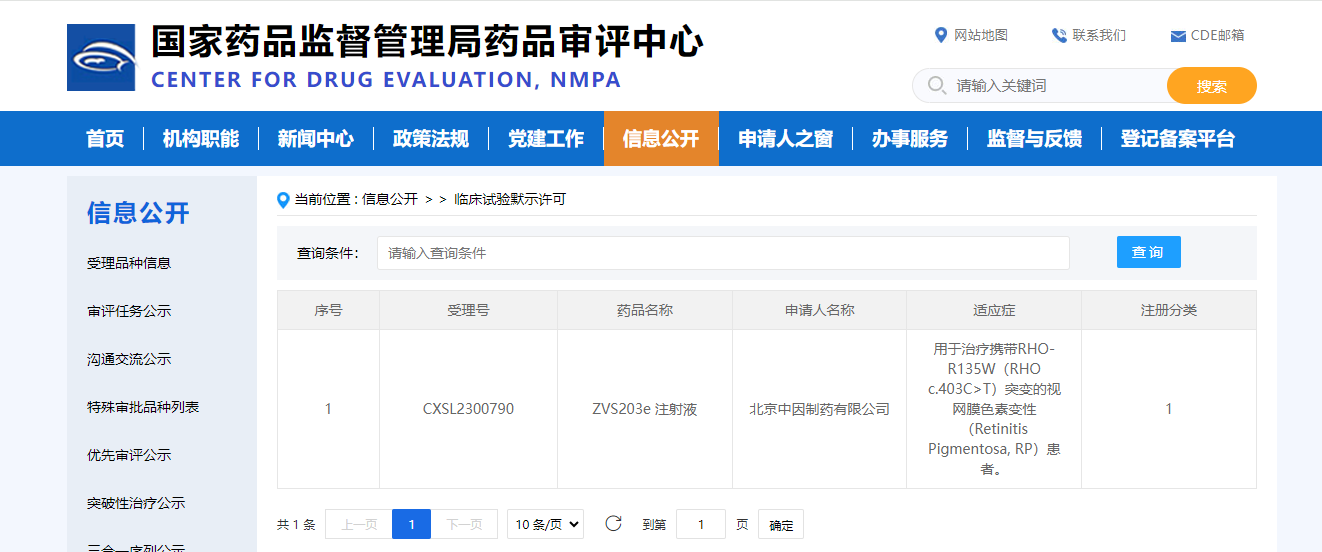
据悉,ZVS203e注射液是一款基因编辑治疗药物,利用第三代人工核酸内切酶CRISPR/Cas9,对RHO基因的突变热点进行定点编辑,达到一次给药终身治愈的效果。该药物于2022年获得FDA孤儿药授权,相关研究成果在2023年6月发表于国际著名生物学综合期刊eLife。2023年12月20日,中因科技研发的ZVS203e注射液,获美国食品药品监督管理局(FDA)临床试验(IND)默示许可。
先博生物
2月7日,先博生物自主研发的靶向CD19的嵌合抗原受体基因修饰的NK细胞注射液正式获得国家药品监督管理局药品审评中心(CDE)的临床默示许可,适应症为中重度难治性系统性红斑狼疮(SLE)。这是SLE适应症在国内首个通用型NK产品获批IND,临床进度甚至有望成为全球领先。

易慕峰
2月7日,易慕峰宣布其自主研发的靶向EpCAM的自体CAR-T细胞注射液产品(IMC001)的临床试验申请获得中国国家药品监督管理局药品审评中心(CDE)的默示许可(受理号:CXSL2300792),用于治疗EpCAM表达阳性的晚期消化系统肿瘤,包括但不限于晚期胃癌(GC)/食管胃结合部腺癌(GEJ)。
IMC001成为全球首个获批IND的靶向EpCAM的CAR-T产品;IMC001已在IIT研究中展示出良好的安全性和有效性。

2月23日,易慕峰又宣布其自主研发的靶向EpCAM的自体CAR-T细胞注射液产品(IMC001)的临床试验申请在中国CDE批准之后,近日又获得了美国FDA的临床研究许可,用于治疗EpCAM表达阳性的晚期消化系统肿瘤,包括但不限于晚期胃癌(GC)/食管胃结合部腺癌(GEJ)。
永泰生物
2月18日,永泰生物-B(06978.HK)aT19注射液成功获得国家药品监督管理局药品审评中心(CDE)药物临床试验批准。
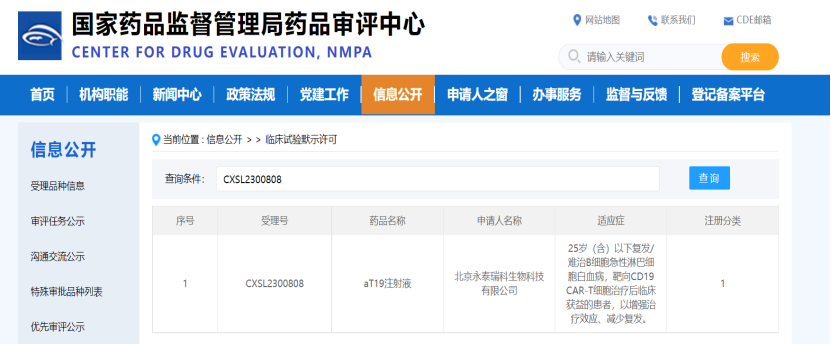
aT19注射液是一种治疗用生物制品,属于生物制品I类,主要功能成分为CD19抗原呈递T细胞。临床试验方案为aT19序贯CAR-T-19注射液治疗25岁(含)以下CD19阳性复发/难治B细胞急性淋巴细胞白血病的Ⅰ期临床研究,拟定适应症为25岁(含)以下复发/难治B细胞急性淋巴细胞白血病,靶向CD19 CAR-T细胞治疗后临床获益的患者,以增强治疗效应、减少复发。本试验将于2024年内开展。
金唯科生物
2月22日,金唯科生物自主研发的针对新生血管性年龄相关性黄斑变性(nAMD)基因治疗产品“JWK001注射液”的新药临床试验(IND)申请顺利获得国家药品监督管理局(NMPA)批准。
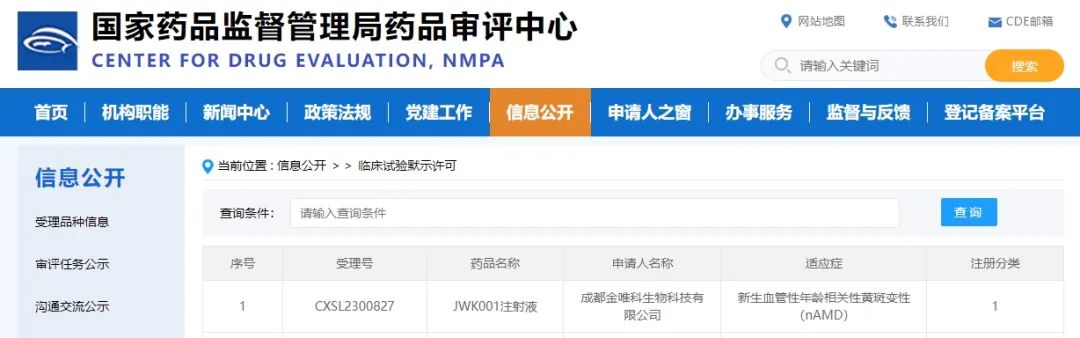
图片来源:CDE官网
JWK001注射液是首个采用“两质粒包装系统”的AAV基因治疗新药。金唯科自主研发的两质粒悬浮HEK293细胞包装技术,大幅提升AAV包装效率、降低生产成本。金唯科的CMC工艺稳定且成本低,在临床阶段以及商业化阶段将具有非常明显的优势,极大提升患者可及性。
圣因生物
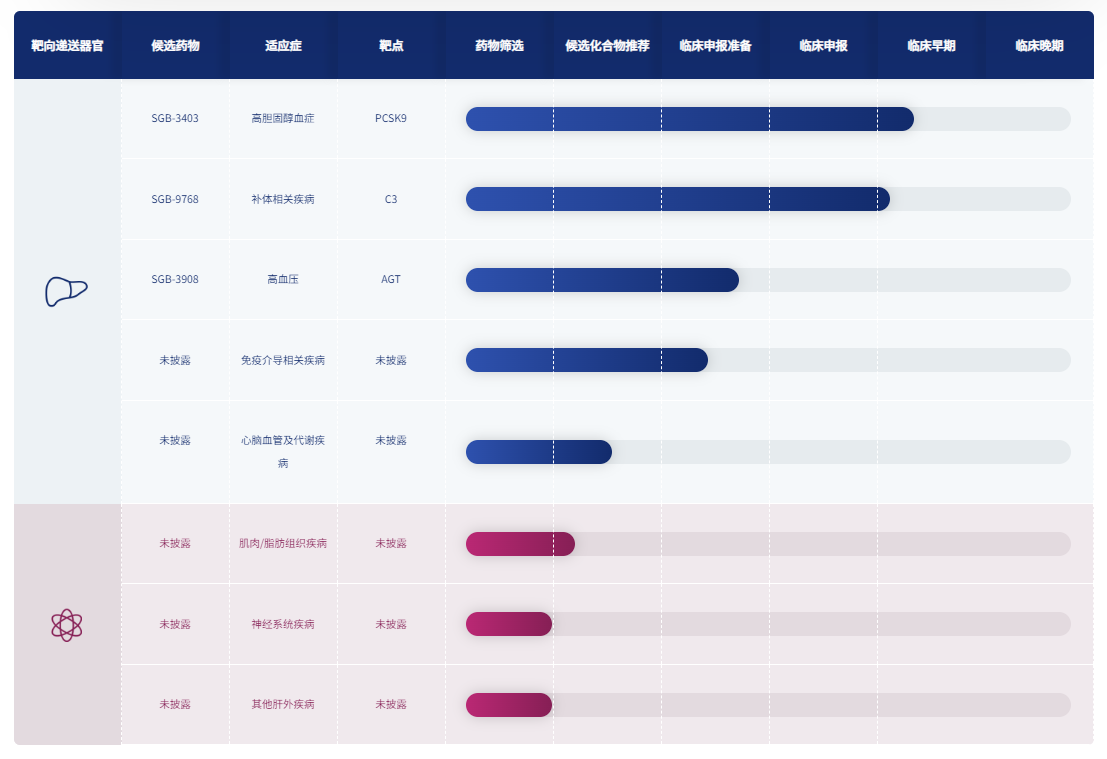
2月26日,圣因生物宣布其自主研发的用于治疗补体相关疾病的siRNA药物SGB-9768已于近日获得新西兰药品和医疗器械安全管理局(Medsafe)、健康及残疾伦理委员会(HDEC)批准,在新西兰开展Ⅰ期临床试验,这是圣因生物第2款进入临床试验阶段的siRNA药物。

SGB-9768是一种靶向补体C3 的 siRNA-GalNAc 结合物,采用了圣因生物独特创新的新一代LEAD™ GalNAc技术递送到肝脏细胞,通过RNAi抑制肝脏C3的合成。GalNAc递送siRNA药物的安全性、有效性、稳定性已得到大量数据验证。本次临床研究是一项随机、双盲、安慰剂对照、单次给药剂量递增的I期研究,主要目的是评估SGB-9768在健康志愿者中的安全性、耐受性、药代动力学及药效动力学特征。
研发管线
总结
自CAR-T疗法Kymriah、Yescarta和基因疗法Zolgensma等自上市以来,销售额增长可观,CGT疗法仍是炙手可热的领域,众多药企纷纷抢占赛道。除以上19款CGT疗法外,在今年三月伊始已有3款CGT疗法获批,分别是GCK-01细胞注射液 、YOLT-201和XMVA09注射液。此外在2月份,香雪生命科学TCR-T产品和君赛生物非病毒载体基因修饰TIL细胞新药IND均获受理有望进入临床阶段,中眸医疗也即将启动ZM-02治疗晚期视网膜色素变性的基因治疗临床试验。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论